
题目列表(包括答案和解析)
①用pH试纸鉴别浓硫酸与浓硝酸
②用硝酸银溶液区分二氧化氮和溴蒸气
③酒精灯被碰倒洒出酒精着火时,迅速用湿抹布扑盖
④用酸性高锰酸钾溶液除去二氧化碳中混有的少量二氧化硫
⑤温度计被摔坏导致水银散落到地面上,应立即用水冲洗水银
⑥称量NaOH固体时,把NaOH固体放在有滤纸的托盘上称量
⑦为了提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液进行酸化
⑧检验氯代烃中的氯元素时,可先加氢氧化钠溶液并加热,再加入硝酸银溶液来进行检验
(2)实验室中利用电石和水反应制取一定量乙炔来进行其性质实验(通入溴水、酸性KMnO4溶液),最后点燃(如下图)。完成下列问题:

①制取乙炔的化学方程式为:__________________________________________。
②实验前,应检查气体发生装置(如上图虚线框内装置)的气密性。某同学用双手捂住烧瓶,把导气管伸入水面下,但无任何气泡冒出,则出现此现象的原因可能是___________(填代号)。
A.没有关闭分液漏斗的活塞
B.橡皮塞上的孔与导管不匹配或橡皮塞与分液漏斗不匹配
C.导管伸入水面下太深
D.烧瓶容积较大
③实验室用上图方法点燃乙炔,由于乙炔在空气中燃烧会产生浓烈的黑烟,所以在实验时点燃后要迅速熄灭火焰。试用一种简单的、安全的操作方法熄灭火焰:_________________________________。
⑴.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是 ▲ 。(可以多选)
A.用pH试纸测定Na2CO3溶液的pH
B.从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
C.实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
D.配制一定物质的量浓度的氯化钠溶液
E.取某溶液做焰色反应实验,说明该溶液中含有钠元素。
F.用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验。
G.促使过饱和的硝酸钾溶液析出晶体
H.用倾析法进行分离、洗涤颗粒较大的沉淀。
⑵.下列实验能达到实验目的且符合安全要求的是 ▲ 。(可以多选)
⑶. 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol·L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体中滴加一滴浓盐酸,再立即将表面皿盖好。已知:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol·L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体中滴加一滴浓盐酸,再立即将表面皿盖好。已知:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
①.e处发生反应的离子方程式为 ▲ ,该反应中发生反应的氧化剂和还原剂的物质的量
之比为 ▲ 。
②.b处的实验现象为 ▲ ,d处的实验现象为 ▲ 。
③.c处反应的化学方程式为 ▲ ,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,
转移电子的物质的量为 ▲ mol。
④.通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱? ▲ (填“能”或
“不能”),若能,其氧化性由强到弱的顺序是 ▲ 。
某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究。
步骤1:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、胶塞等装配如图所示的装置。另准备一只胶塞,其中有一根铜丝穿过,铜丝末端固定一根镁条备用。
步骤2:引燃燃烧匙中的试剂,塞好瓶塞。燃烧结束后,调节广口瓶内外液面相平。
步骤3:点燃镁条,更换胶塞,镁条继续燃烧,反应结束后,广口瓶内水面上升。
步骤4:取蒸发皿中得到的固体,加盐酸溶解。向溶液中加入过量氢氧化钠溶液,有白色沉淀生成,同时得到一种能使湿润红色石蕊试纸变蓝的气体。
⑴为除去广口瓶中的氧气,燃烧匙中应装入下列试剂中的 ▲ (填序号)。
A.炭粉 B.硫粉 C.红磷
⑵“步骤2”中调节内外液面相平的方法: ▲ 。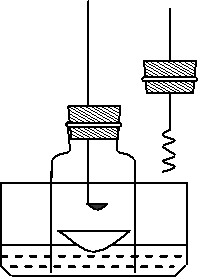
⑶写出Mg3N2溶于足量盐酸生成两种氯化物的化学方程式: ▲ 。
⑷某同学直接将镁条在空气中点燃,并将所得白色固体进行“步骤4”的实验,结果无气体生成,其原因是 ▲ 。
⑸兴趣小组同学为比较镁和铝的金属性强弱,设计了下表中的实验方案一,请你再设计一种不同的实验方案。
实验试剂和用品:镁条、铝条、0.1mol/L MgCl2溶液、0.1mol/L AlCl3溶液、0.1mol/L HCl溶液、 0.1mol/L NaOH溶液、pH试纸(其他实验仪器可任选)
实验操作 | 实验现象 | |
方案一 | 取已除去表面氧化膜的镁条和铝条,分别和0.1mol/L HCl溶液反应 | 均有气泡产生,镁条反应比铝条反应更剧烈 |
方案二 | ▲ | ▲ |
用氯气对饮用水消毒已有百年历史,但人们逐渐发现其副作用愈来愈明显:①pH的变化,对消毒能力影响大;②使饮用水中有机物发生氯代,生成上百种影响人体健康的有机氯衍生物,同时使人产生味觉、嗅觉不适感.世界环保联盟建议用另一种高效消毒剂二氧化氯(ClO2)代替氯气对饮用水消毒.ClO2具有很强的氧化性,通常状况下是黄绿色气体,水溶性是Cl2的5倍,溶于水成黄绿色的溶液,在pH为2~5范围内,在水中以分子形式存在,不水解,也不聚合.ClO2很不稳定,与空气混合后,当它的体积分数>10%时,受强光或强振动可能发生爆炸.
完成下列问题:
(1)氯气对饮用水消毒的原理是________.氯气的消毒能力受水的pH影响,pH小时的消毒能力________pH大时的消毒能力(填“>”或“<”),其原因是________.
(2)通常用氯酸钠(NaClO3)与浓盐酸反应来制取ClO2,同时生成Cl2,写出化学方程式:________.市售的一种新型消毒剂含两种成分,分别是NaClO3和Na2C2O4.两种成分在溶液中混合便产生ClO2,写出化学方程式:________.
某同学打算通过研究性学习,比较这两种制取ClO2的方法的利与弊.要拟定一个简略的研究方案,你认为应该从哪些方面进行研究?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com