
题目列表(包括答案和解析)
A.1 mol氦气中有2NA个氦原子
B.14 g氮气中含NA个氮原子(氮的原子量为14)
C.2 L 0.3 mol·L-1Na2SO4溶液中含0.6 NA个Na+
D.18 g水中所含的电子数为8NA
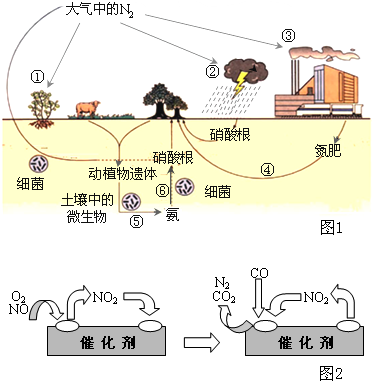 氮是生命的基础,由于存在着氮的循环,生命世界才能像我们所见到的那样生机勃勃,充满活力.如图1是自然界中氮的循环图,请回答有关问题.
氮是生命的基础,由于存在着氮的循环,生命世界才能像我们所见到的那样生机勃勃,充满活力.如图1是自然界中氮的循环图,请回答有关问题.
| ||
| ||

 2NO2(g)在前1l0s内的反应进
2NO2(g)在前1l0s内的反应进
| [NO2]2 |
| [N2O4] |
| [NO2]2 |
| [N2O4] |
氮是生命的基础,由于存在着氮的循环,生命世界才能像我们所见到的那样生机勃勃,充满活力。下图是自然界中氮的循环图,请回答有关问题。

(1)从空气中获取氮是人类长久以来追求的目标。下列有关说法正确的是_________(填序号)。
a.图中①②③④⑤都属于自然界的固氮过程
b.在过程⑥中,氮元素的化合价降低
c.反应②的化学方程式是N2 +O2
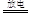 2NO
2NO
d.德国化学家哈伯发明了合成氨工艺,其主要反应如下2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)氨经氧化后可得到硝酸,而硝酸能与氨形成含氮量很高的肥料NH4NO3,施用于土壤而实现非自然形式的氮循环。但这种肥料不适宜与碱性物质共用,否则会降低肥效,其原因是_________________________________(用离子方程式表示)。
(3)人类活动对氮循环产生着明显的影响。汽车尾气中的NO,是造成光化学烟雾的物质之一,但NO对人体又起着独特的生理作用,被誉为“明星分子”,有三位科学家因此项研究成果而获得1998年诺贝尔奖。上述事实说明我们应辨证地看待化学物质的作用。科技人员已经找到了一些解决NO排放的方法。在汽车尾气排放管中安装一个催化转化器,可将尾气中另一种有害气体CO跟NO反应转化为空气中的两种成分。气体在催化剂表面吸附与解吸作用的机理如下图所示。
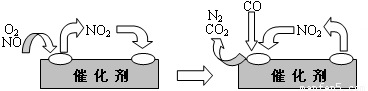
写出上述变化中的总化学反应方程式____________________________________。
氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过反应:Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1 mol AlN需转移3 mol电子
C.AlN中氮的化合价为+3
D.AlN的摩尔质量为41 g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com