
题目列表(包括答案和解析)
(1)气体为________,红褐色沉淀是________。
(2)上述现象产生的理由是________________________。
在氯化铁溶液中,加入难溶于水的碳酸钙粉末,发现碳酸钙逐渐溶解并产生________现象,试运用电解质溶液理论简述产生以上现象的原因是________,并写出有关的离子方程式________.

 )=2.50×10-4 mol·L-1,则Ca2+_ _____(填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5 mol·L-1可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
)=2.50×10-4 mol·L-1,则Ca2+_ _____(填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5 mol·L-1可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]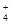 ) c(NO
) c(NO ) (填 > 、< 或 = ),(NH4)2CO3溶液中离子浓度由大到小的顺序为 。
) (填 > 、< 或 = ),(NH4)2CO3溶液中离子浓度由大到小的顺序为 。
| |||||||||||||||||||||||||||||||||||||

 CaO2+2HCl
CaO2+2HCl CaO2+2HCl
CaO2+2HCl湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com