(2009?宿迁二模)某研究性学习小组对过量炭粉与氧化铁反应中气体产物的成分进行了研究.
[提出假设]该反应中的气体产物可能是CO或者是CO
2和CO的混合物.
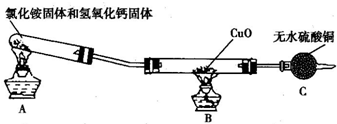
[查阅资料]氮气不与碳、氧化铁发生反应.实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO
2)饱和溶液混合加热反应制得氮气.
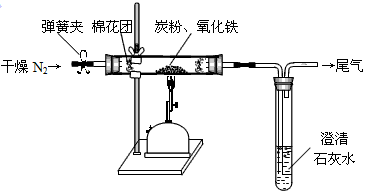
[设计方案]如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比.

试回答下列问题:
(l)按上图连接装置,如何检查该装置的气密性
在整套装置末端接一带弯玻璃导管的乳胶管,并将玻璃导管末端放在盛有水的水槽中;用酒精灯在气体发生装置下面微热(打开弹簧夹),玻璃导管末端有气泡产生;停止加热后,玻璃导管内上升一段水柱,则不漏气
在整套装置末端接一带弯玻璃导管的乳胶管,并将玻璃导管末端放在盛有水的水槽中;用酒精灯在气体发生装置下面微热(打开弹簧夹),玻璃导管末端有气泡产生;停止加热后,玻璃导管内上升一段水柱,则不漏气
(2)广口瓶内盛放的试剂为
浓硫酸
浓硫酸
,其作用为
吸收产生的氮气中的水,获得干燥的氮气
吸收产生的氮气中的水,获得干燥的氮气
(3)实验开始时,应先打开弹簧夹,一段时间后关闭;再点燃酒精喷灯,理由是
为了排尽整套装置中的空气
为了排尽整套装置中的空气
.
(4)称取3.20g氧化铁、2.00g炭粉混合均匀,放入质量为48.48g的硬质玻璃管中;待反应结束,再通一段时间的氮气.冷却至室温,称得硬质玻璃管和固体总质量为52.24g.经进一步测定得知参加反应的氧元素质量为0.96g.从而确认该反应的气体产物是C0
2和CO的混合物,理由是
经计算反应后的气体中碳、氧原子的物质的量之比为 2:3,介于 1/2 和 1 之间
经计算反应后的气体中碳、氧原子的物质的量之比为 2:3,介于 1/2 和 1 之间
.根据数据处理结果判断,反应产生的气体中n(CO
2):n(CO)=
1:1
1:1
.
(5)有同学根据实验得出的结论,认为应对实验装置进一步完善,你认为应作如何改进?
在尾气出口处加一点燃的酒精灯或增加一尾气处理装置
在尾气出口处加一点燃的酒精灯或增加一尾气处理装置
.