
题目列表(包括答案和解析)
氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用氯气。
I.工业上通常采用电解法制氯气:观察右图,回答:

(1)若饱和食盐水中通电后b侧产生的气体通入NaOH溶液中所发生的反应的离子方程式为 。
(2)电解反应的化学方程式为 。
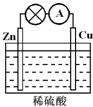
II.某学生设计如右图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题:

(1)在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,反应化学方程式为 ▲ ,若在标准状态下收集到22.4升的氯气,则被氧化的HCl的物质的量是 ▲ 。
(2)漂白粉将在U形管中产生,其化学方程式是 ▲ 。
(3)C装置的作用是 ▲ 。
(4)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是 ▲ 。
②试判断另一个副反应(用化学方程式表示) ▲ 。为避免此副反应的发生,可将装置作何改进 ▲ 。
(5)家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是 ▲ 。
A.食盐 B.食醋 C.烧碱 D.纯碱
(08揭阳市一模)(10分)(1)下面所列的是中学化学实验室中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、 普通漏斗、玻璃棒、烧杯。
①若要进行中和滴定实验,还缺少的玻璃仪器是______________________.
②若要用碳酸钠固体配制一定物质的量浓度的碳酸钠溶液,还缺少的玻璃仪器是________.
(2)某学生往一支试管中按一定的顺序分别加入下列几种溶液(一种溶液只加一次):
A.KI溶液 B.淀粉溶液 C.NaOH溶液 D.稀H2SO4 E.氯水。
发现溶液颜色按如下顺序变化:无色→棕黄色→蓝色→无色→蓝色。
依据溶液颜色的变化,判断加入以上药品的顺序是(填写序号) 。
 (3)众所周知,氢气燃烧生成水。然而,资料表明,
(3)众所周知,氢气燃烧生成水。然而,资料表明,
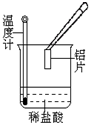
氢气燃烧时除生成水外,还生成另一产物。某同学用如右图所示的实验装置,验证该产物的存在。实验步骤及现象如下:制H2、验纯,将火焰对着冰块。
① 在小烧杯内加入用硫酸酸化的稀KI淀粉溶液,将小烧杯放在冰块下方,
观察到烧杯中溶液由无色变成了蓝色。
②在另一个小烧杯内加入用硫酸酸化的稀KMn04溶液,将小烧杯放在冰块下方,观察到烧杯中溶液变成了无色。请你写出另一产物的结构式: ;
由上述实验中可以归纳出该产物的化学性质有 。 能源是现代社会发展的支柱之一,化学能是重要的能源.
能源是现代社会发展的支柱之一,化学能是重要的能源.
某学生在如右图所示装置中用苯和液溴制取溴苯,请根据下列实验步骤回答有关问题:
(1)第一步,在分液漏斗中依次加入10 mL苯和5 mL液溴,使之混合均匀,此时观察到溴溶于苯,不反应,溶液呈深棕红色。

第二步,打开分液漏斗活塞,将苯、溴混合液按一定速率逐滴加入玻璃管甲中的铁丝上,观察到的现象是______________________________________________________。
从上述两步观察到的现象差异,可得出的结论是__________________________________。
(2)第三步,几分钟后,打开胶皮管夹A和B,使反应混合液流入U形管中,打开管夹B的原因是________________________________________________;然后通过分液漏斗向U形管中加入适量的NaOH溶液,目的是__________。
(3)第四步,关闭胶皮管A和B,连同A和B一起取下U形管,用力振荡并静置后,观察到溴苯的颜色是__________,它在U形管中液体的______________(填“上”或“下”)层。此步关闭管夹A和B的目的是______________________________________________________。
(4)要证明上述溴跟苯的反应是取代而不是加成反应,请根据装置乙的作用完成下列各题:
①小试管内的液体是__________(填名称),作用是______________________________。
②锥形瓶内的液体是__________(填名称),作用是______________________________。
③反应后,向锥形瓶内滴加试剂__________(填名称)溶液,作用是__________。此外,装置乙还能起到__________的作用。
(5)写出上述苯跟溴反应的化学方程式________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com