
题目列表(包括答案和解析)

已知:A为淡黄色固体,E、X常温下为气体,A、B、C、D含有相同的金属离子,其转化关系如右(部分产物已略去)。

请回答下列问题:
(1) 常温常压下,3.9gA与足量的氷充分反应放出热量akJ,写出该反应的热化学方程式________
(2) 向500mL0.3mol/L的B溶液中缓慢通入2.24L(标准状况下)的气体X,则所得混合溶液中各离子浓度由大到小的顺序是________________
(3) 已知20°C时的溶解度:S(Na2CO3)=21.2g,S(NaHCO3)=9.6g。则20°C恒温条件下向121.2g饱和碳酸钠溶液中通入足量的CO2气体,理论上可以析出 NaHCO3 ________g (小数点后保留1位)
(4) 现有甲、乙两瓶无色溶液,已知它们可能是以下四种溶液:MgCl2溶液、 AlCl3溶液、NaOH溶液、氨水中的两种,现做如下实验:
①取440mL甲与120mL乙反应,产生1.56g白色沉淀M
②取440mL乙与120mL甲反应,也产生1. 56g白色沉淀M
③取120mL甲溶液与400mL乙溶液反应,则产生3.12g白色沉淀M;通过必要的计算和推理判定:甲溶液为__________溶液,乙溶液为________溶液。
(14分)已知:A为含金属离子的淡黄色固体化台物,E、X为空气中常见气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物已略去)。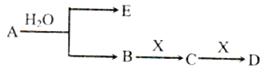
请回答下列问题
(1)这种金属离子的离子结构示意图为_____________;
(2)X的电子式_______________;
(3)B中所含化学键的类型是_____________;
常温常压下,7.8gA与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式
_________________________________________________________________.
(4)①C也可转化为B,写出该转化的化学方程式_______________________________;
②B与D反应的离子方程式为_______________________________________.
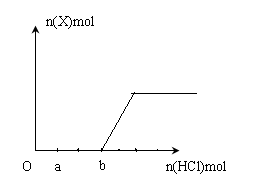
(5)将一定量的气体X通入2LB的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量, 产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。
请回答:a点溶液中所含溶质的化学式为__________ ,b点溶液中各离子浓度由大到小的关系是_________________________________。

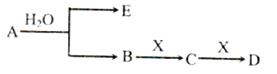
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com