在一定体积的密闭容器中,进行如下化学反应:
CO
2(g)+H
2(g)?CO(g)+H
2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
(1)该反应的化学平衡常数表达式为K=
.
(2)该反应为
吸热
吸热
反应(选填“吸热”、“放热”).
(3)若 830℃时,向容器中充入1mol CO、5mol H
2O,反应达到平衡后,其化学平衡常数K
等于
等于
1.0(选填“大于”、“小于”、“等于”)
(4)若1200℃时,在某时刻该容器中CO
2、H
2、CO、H
2O的浓度分别为2mol?L
-1、2mol?L
-1、4mol?L
-1、4mol?L
-1,则此时上述反应的平衡移动方向为
逆反应方向
逆反应方向
.(选填“正反应方向”、“逆反应方向”、“不移动”)
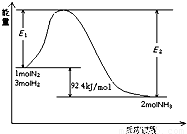
(5)科学家一直致力于“人工固氮”的方法研究.目前合成氨的技术原理为:
N
2(g)+3H
2(g)?2NH
3(g)△H=-92.4kJ/mol
该反应的能量变化如图所示.
①在反应体系中加入催化剂,反应速率增大,E
2的变化是:
减小
减小
.(填“增大”、“减小”或“不变”).
②将一定量的N
2(g)和H
2(g)放入2L的密闭容器中,在500℃、2×10
7Pa下发生如下反应:N
2(g)+3H
2(g)?2NH
3(g)
5分钟后达到平衡,测得N
2为0.2mol,H
2为0.6mol,NH
3为0.2mol.氮气的平均反应速率v(N
2)=
0.01mol/L?min
0.01mol/L?min
,H
2的转化率是
33.3%
33.3%
.
③欲提高②容器中H
2的转化率,下列措施一定可行的是
ACD
ACD
.
A.增大压强
B.改变反应的催化剂
C.液化生成物分离出氨
D.向容器中按原比例再充入原料气
E.升高温度.

 在一定体积的密闭容器中,进行如下化学反应:
在一定体积的密闭容器中,进行如下化学反应: