
题目列表(包括答案和解析)
有机物A、B、C互为同分异构体,分子式均为C5H8O2,有关的转化关系如下图所示。已知:
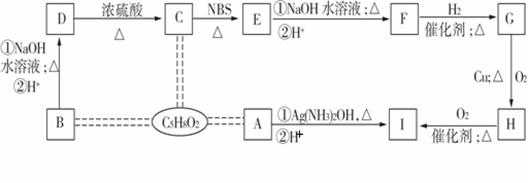
①A
单质Ag;
②B为含有一个五元环的酯;
③CH3—CH===CH—R![]() CH2BrCH===CHR
CH2BrCH===CHR
请回答下列问题:
(1)C中不含氧的官能团的名称是 ,D转化为C的反应类型______________。
(2)B、H的结构简式依次为 、 。
(3)F的加聚反应产物的结构简式为 。
(4)E不能发生反应的反应类型有 (填序号,多选、漏选或错选均不得分)。
①取代反应 ②加成反应 ③银镜反应 ④水解反应 ⑤消去反应 ⑥聚合反应 ⑦氧化反应 ⑧还原反应 ⑨皂化反应 ⑩酯化反应
(5)写出E→F的反应方程式(只写①条件下的反应,有机物用结构简式表示):
。
(6)M是D的同分异构体,且符合以下条件:①分子中只含有一个甲基(—CH3);②能发生银镜反应;③1 mol M与足量Na反应能产生标准状况下22.4 L的气体;④除官能团上的氢原子外,还有两种不同类型的氢原子。请任意写出一种符合条件的M的结构简式:
。
的碳链无支链,且0.1 mol A能与足量Ag(NH3)2OH完全反应可得到43.2 g有机物A、B、C互为同分异构体,分子式均为C5H8O2,有关的转化关系如下图所示.已知:
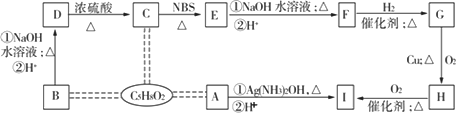
①A的碳链无支链,且0.1 mol A能与足量Ag(NH3)2OH完全反应可得到43.2 g
单质Ag;
②B为含有一个五元环的酯;
③CH3-CH![]() CH-R
CH-R![]() CH2BrCH
CH2BrCH![]() CHR
CHR
请回答下列问题:
(1)C中不含氧的官能团的名称是________,D转化为C的反应类型________.
(2)B、H的结构简式依次为________、________.
(3)F的加聚反应产物的结构简式为________.
(4)E不能发生反应的反应类型有________(填序号,多选、漏选或错选均不得分).
①取代反应
②加成反应
③银镜反应
④水解反应
⑤消去反应
⑥聚合反应
⑦氧化反应
⑧还原反应
⑨皂化反应
⑩酯化反应
(5)写出E→F的反应方程式(只写①条件下的反应,有机物用结构简式表示):________.
(6)M是D的同分异构体,且符合以下条件:①分子中只含有一个甲基(-CH3);②能发生银镜反应;③1 mol M与足量Na反应能产生标准状况下22.4 L的气体;④除官能团上的氢原子外,还有两种不同类型的氢原子.请任意写出一种符合条件的M的结构简式:________.
25℃时,0.1 mol·L-1 HA溶液pH=2,0.1 mol·L-1 HB溶液pH=3.
(1)前者大于后者的是________(多选、错选均不给分,下同);
①HA、HB的电离平衡常数
②HA、HB的电离度
③溶液中的c(OH-)
④溶液的导电性
⑤溶液中由水电离出的c(H+)
(2)若HA、HB溶液的pH相同、体积相等,前者小于后者的是________;
①HA、HB物质的量浓度
②同时加入足量的锌,开始反应时速率
③同时加入足量的锌,反应完全后生成H2的质量
④二种酸溶液的导电能力
⑤用1 mol/L NaOH溶液分别中和二种酸,消耗NaOH溶液体积
⑥将这两种溶液分别稀释10倍后溶液的pH.
(3)若中和体积为Va浓度为0.1 mol·L-1 HA溶液,消耗0.1 mol·L-1 NaOH溶液的体积为Vb,且Va>Vb,下列说法一定正确的是________.(提示:CH3COONa溶液呈碱性)
①混合后溶液呈中性
②混合后溶液呈酸性
③混合后溶液呈碱性
④混合后溶液中的溶质为
NaA⑤混合后溶液中的溶质为
NaA和HA⑥混合后溶液中的溶质为
NaA和NaOH(8分) (1)下列实验方法合理的是 (多选或错选不给分)
A、用加热法除去食盐固体中的氯化铵
B、将碘的饱和水溶液中的碘提取出来,可用酒精进行萃取
C、实验室制取Al(OH)3: 往AlCl3溶液中加入NaOH溶液至过量
D、往FeCl2溶液中滴入KSCN溶液,检验FeCl2是否已氧化变质
(2)SiO2广泛存在自然界中,其用途也非常广泛,可用于制造光导纤维,也用于生产半导体材料硅。写出工业上用石英制备粗硅的化学反应方程式
(3)铝是一种重要金属:铝与NaOH溶液反应的离子方程式为:
(4)将10.7g 氯化铵固体与足量消石灰混合加热使之充分反应。生成气体在标准状况下的体积是 L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com