
题目列表(包括答案和解析)
加入物质 结果 变化量 | H2O | NH4Cl(s) | NaOH(s) | HCl(l) |
n(OH-) |
|
|
|
|
c(OH-) |
|
|
|
|
平衡移动方向 |
|
|
|
|
| 一定条件 |
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
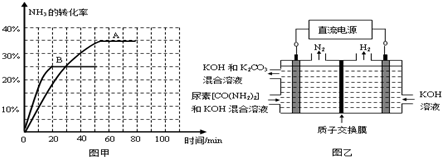
燃料在电池中直接氧化而产生电能的装置叫燃料电池,它是一种高效低污染的新型电池.燃料电池所用燃料可以是氢气,也可以是其他燃料,如甲醇、肼等.肼分子(H2N-NH2)可以在氧气中燃烧生成氮气和水,回答下列问题:
(1)
利用肼、氧气与KOH溶液组成碱性燃料电池,请写出该电池反应的电极反应式和总反应式;并指出电解质溶液中,OH-离子向哪极移动;(2)肼在水中,通常结合一分子水,形成H2N-NH2·H2O,其一级电离与NH3·H2O的电离类似,H2N-NH2·H2O水溶液的碱性可以通过只考虑其一级电离求出,其一级电离的电离常数Kb=3.0×10-6,为了求浓度为0.1 mol/L肼溶液的OH-浓度,人们常将Kb=[H2N-NH3+]·[OH-]/[H2N-NH2·H2O]近似为Kb=[OH-]2/0.1,请给出理由.
(3)
肼是强还原剂,与氧化剂反应时放出大量的热,如:N2H4(l)
+2H2O2(l)=N2(g)+4H2O(g) ΔH=-642.2 kJ·mol-1,因此肼可以作为火箭推进剂.根据该反应,你认为是否可以通过改变反应条件,由N2和水来制取N2H4,若能指出可能的反应条件;若不能请指出原因.| a |
| 200b |
| a |
| 200b |
| 改变条件 | 电离平衡移动 方向 |
电离度 | c(H+) | c(CH3COO-) |
| 加水稀释 | ||||
| 加少量HCl溶液 | ||||
| 加入少量CH3COONa固体 |
| c(NH4+).c(OH-) |
| c(NH3.H2O) |
| c(NH4+).c(OH-) |
| c(NH3.H2O) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com