
题目列表(包括答案和解析)

| 加热 |
| 加热 |
| 加热 |
| 加热 |
氨是一种重要的化工产品,是氮肥工业及制造硝酸的原料。为探究氨气的性质,某研究性学习小组做了以下实验:
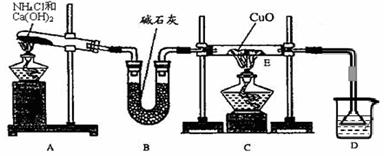
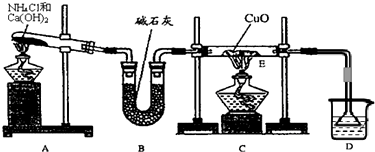
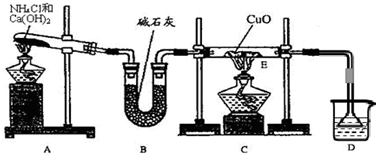
⑴ 实验室用A图所示实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物来制取氨气。
① 实验室制取氨气的化学方程式为 。
② 若用加热碳酸氢铵固体制取纯净的氨气,你认为装置中U型管的作用是
。
⑵ 在实验中发现E装置中的固体由黑色变为红色,可推测氨气具有 性。
⑶ 某同学查阅资料发现Cu2O粉末也呈红色,因此推测上述红色固体中可能还含有Cu2O。已知:① Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+。
② 在空气中高温灼烧时:Cu2O稳定、不分解,而CuO将分解生成Cu2O和O2。
现有浓硝酸、稀硫酸、稀硝酸、氢氧化钠溶液及pH试纸,而没有其他试剂,请用最简便的实验方法证明红色固体中是否含有Cu2O。(简述操作方法、现象和结论)
![]() ⑷ 现有一份一定质量Cu和Cu2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况),向所得溶液中加入一定体积1.0mol/L NaOH溶液恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体。下列有关说法正确的是【已知:3Cu2O + 14HNO3(稀) 6Cu(NO3)2 + 2NO↑+ 7H2O】___________
⑷ 现有一份一定质量Cu和Cu2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况),向所得溶液中加入一定体积1.0mol/L NaOH溶液恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体。下列有关说法正确的是【已知:3Cu2O + 14HNO3(稀) 6Cu(NO3)2 + 2NO↑+ 7H2O】___________
A.加入NaOH溶液的体积为1.2L
B.Cu和Cu2O混合物质量为27.2g
C.混合物完全溶解后溶液中n(H+)=0.3mol
D.将等质量混合物完全还原至少需标准状况下H21.12L
| H+ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com