
题目列表(包括答案和解析)
在373K时,把11.5g N2O4气体通入体积为500mL的真空容器中发生反应:N2O4 2NO2,并立即出现红棕色,反应进行到2s时,NO2含量为0.01mol,进行到60s时,达到平衡,此时容器内混合气体的密度是氢气密度的28.75倍,则
2NO2,并立即出现红棕色,反应进行到2s时,NO2含量为0.01mol,进行到60s时,达到平衡,此时容器内混合气体的密度是氢气密度的28.75倍,则
(1)开始2s内以N2O4的浓度变化表示的反应速率为多少?
(2)达到平衡时体系内压强是开始时的多少倍?
在373K时,把11.5g![]() 气体通入体积为500mL的真空密闭容器中,立即出现红棕色;反应进行到2s时,
气体通入体积为500mL的真空密闭容器中,立即出现红棕色;反应进行到2s时,![]() 含量为0.01mol;进行到60s时,达到平衡此时容器内混合气体的密度是
含量为0.01mol;进行到60s时,达到平衡此时容器内混合气体的密度是![]() 密度的28.75倍.则下列叙述中正确的是
密度的28.75倍.则下列叙述中正确的是
[
]A.开始时以![]() 表示的反应速率为0.01mol/(L·s)
表示的反应速率为0.01mol/(L·s)
B
.达到平衡时,体系内压强是开始时的1.6倍C
.平衡时,D
.平衡后,若压缩容器减小体积,则再达平衡后,NO2的浓度下降| 假设 | 实验验证方法及现象 | |
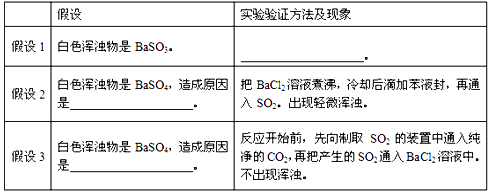
| 假设1 | 白色浑浊物是BaSO3. | 在白色浑浊物中加入过量盐酸,变澄清 在白色浑浊物中加入过量盐酸,变澄清 . |
| 假设2 | 白色浑浊物是BaSO4,造成原因是 BaCl2溶液中溶解的氧气把亚硫酸氧化成硫酸 BaCl2溶液中溶解的氧气把亚硫酸氧化成硫酸 . |
把BaCl2溶液煮沸,冷却后滴加苯液封,再通入SO2.出现轻微浑浊. |
| 假设3 | 白色浑浊物是BaSO4,造成原因是 SO2中混有空气,把亚硫酸氧化成硫酸 SO2中混有空气,把亚硫酸氧化成硫酸 . |
反应开始前,先向制取SO2的装置中通入纯净的CO2,再把产生的SO2通入BaCl2溶液中.不出现浑浊. |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com