
题目列表(包括答案和解析)
在CH3COONa溶液中,各种离子浓度从小到大的顺序是( )
A.c(H+)<c(OH-)<c(CH3COO-)<c(Na+)
B.c(H+)<c(OH-)<c(Na+)<c(CH3COO-)
C.c(H+)<c(CH3COO-)<c(OH-)<c(Na+)
D.c(OH-)<c(CH3COO-)<c(H+)<c(Na+)
| A.c(H+)<c(OH-)<c(CH3COO-)<c(Na+) |
| B.c(H+)<c(OH-)<c(Na+)<c(CH3COO-) |
| C.c(H+)<c(CH3COO-)<c(OH-)<c(Na+) |
| D.c(OH-)<c(CH3COO-)<c(H+)<c(Na+) |
描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp).
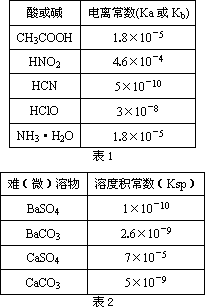
请回答下面问题:
(1)上述四种酸中,酸性最弱的是________(用化学式表示).下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是________(填序号).
A.升高温度
B.加水稀释
C.加少量的CH3COONa固体
D.加少量冰醋酸
(2)CH3COONH4的水溶液呈________(选填“酸性”、“中性”、“碱性”),理由是________.
(3)物质的量1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为________.
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2).具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3.现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0.01 mol·L-1以上,则溶液中CO32-物质的量浓度应≥________mol·L-1
描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp).
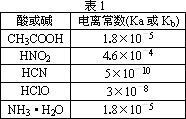
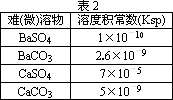
请回答下面问题:
(1)上述四种酸中,酸性最强的是________(用化学式表示).下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是________(填序号).
A.升高温度
B.加水稀释
C.加少量的CH3COONa固体
D.加少量冰醋酸
(2)CH3COONH4的水溶液呈________(选填“酸性”、“中性”、“碱性”),溶液中各离子浓度大小的关系是________.
(3)物质的量1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为________.
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2).具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3.现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0.01 mol·L-1以上,则溶液中CO32-物质的量浓度应≥________mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com