
题目列表(包括答案和解析)
A.反应容器内压强不随时间而变化
B.A气体和B气体的生成速率相等
C.A、B、C三种气体的生成速率相等
D.反应混合气体的密度不随时间而变化
对于固定体积的密闭容器中进行的气体反应,可以说明A(g)+B(g)ƒC(g)+D(g),在恒温下已经达到平衡状态的是( )
A.反应容器内压强不随时间而变化
B.A气体和B气体的生成速率相等
C.A、B、C三种气体的生成速率相等
D.反应混合气体的密度不随时间而变化
(14分)工业上以乙苯为原料生产苯乙烯的反应如下(Ph代表苯基):
Ph—CH2CH3(g) Ph—CH=CH2(g)+H2(g) △H
Ph—CH=CH2(g)+H2(g) △H
某研究小组为探究温度等因素对该反应的产率影响,在容积可变的密闭容器中分别作了四组实验,实验结果如下图a、b所示。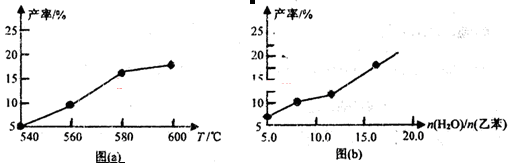
(1)根据反应及上图(a),判断△H 0(填“<”“=”或“>”,下同),△S 0;请选择经济、且适宜的反应温度: 。
(2)下列事实可以说明该反应已达平衡的是 。
A.混合气体的密度不再变化
B.氢气的体积分数保持不变
C.氢气、苯乙烯的生成速率之比保持不变
D.单位时间内消耗的n(乙苯)等于生成的n(H2)
(3)从压强因素分析,为提高乙苯的转化率,应采用 的生产条件。实际工业生产中常采用通入水蒸气的方法。水蒸气的含量对反应的影响结果如上图(b)所示。
①在做这四组实验时,应该采用的其他实验条件是 。
A.反应温度相同 B.采用不同的催化剂
C.压强都控制在常压下 D.反应相同时间时测定实验数据
②图(b)表明: 。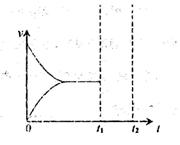
③一定温度下,在恒压密闭容器中,通入一定量n(H2O)/n(乙苯)=7:1的气体,发生上述反应,在t1时刻达到平衡。保持其他条件不变,此时分离出一定量的水蒸气,在t2时刻重新达到平衡,请在右图中画如反应再次达到平衡过程的图像。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com