
题目列表(包括答案和解析)
某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在。所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。
背景资料:
①锌与铝性质相似,可以与NaOH溶液反应生成H2和Na2ZnO2;
②Zn(OH)2为白色固体,难溶于水,可溶于强碱和氨水。与氨水反应生成配合物[Zn(NH3)4]2+,该配合物遇强酸反应生成Zn2+、NH4+
甲同学设计的实验方案如下:
(1)方案中试剂M是 ;沉淀B是 。
(2)操作Ⅰ的主要过程是:在滤液中逐滴加入 ,直至生成的沉淀刚好溶解,再加入足量的 。
(3)若金属中含铝,则沉淀 (选填沉淀编号)的质量不为零;若金属中含锌,则沉淀 (选填沉淀编号)的质量不为零。
(4)乙同学对甲同学的方案做了如下改进:
与甲同学的方案相比,此方案的优点有 。
(5)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则生成沉淀的物质的量与加入NaOH溶液体积关系的图像正确的是 。
(6)上题中当沉淀质量最大时,溶液呈 (从下列选项中选填,下同);当沉淀只有一种成分时,溶液可能呈 。
A.酸性 B.中性 C.碱性 D.可能酸性,也可能碱性
某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在。所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。
背景资料:
①锌与铝性质相似,可以与NaOH溶液反应生成H2和Na2ZnO2;
②Zn(OH)2为白色固体,难溶于水,可溶于强碱和氨水。与氨水反应生成配合物[Zn(NH3)4]2+,该配合物遇强酸反应生成Zn2+、NH4+
甲同学设计的实验方案如下:
(1)方案中试剂M是 ;沉淀B是 。
(2)操作Ⅰ的主要过程是:在滤液中逐滴加入 ,直至生成的沉淀刚好溶解,再加入足量的 。
(3)若金属中含铝,则沉淀 (选填沉淀编号)的质量不为零;若金属中含锌,则沉淀 (选填沉淀编号)的质量不为零。
(4)乙同学对甲同学的方案做了如下改进: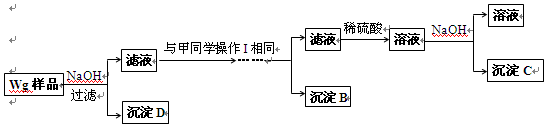
与甲同学的方案相比,此方案的优点有 。
(5)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则生成沉淀的物质的量与加入NaOH溶液体积关系的图像正确的是 。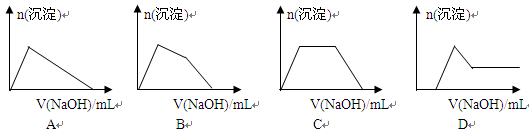
(6)上题中当沉淀质量最大时,溶液呈 (从下列选项中选填,下同);当沉淀只有一种成分时,溶液可能呈 。
| A.酸性 | B.中性 | C.碱性 | D.可能酸性,也可能碱性 |
某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在。所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。
背景资料:
①锌与铝性质相似,可以与NaOH溶液反应生成H2和Na2ZnO2;
②Zn(OH)2为白色固体,难溶于水,可溶于强碱和氨水。与氨水反应生成配合物[Zn(NH3)4]2+,该配合物遇强酸反应生成Zn2+、NH4+
甲同学设计的实验方案如下:

(1)方案中试剂M是 ;沉淀B是 。
(2)操作Ⅰ的主要过程是:在滤液中逐滴加入 ,直至生成的沉淀刚好溶解,再加入足量的 。
(3)若金属中含铝,则沉淀 (选填沉淀编号)的质量不为零;若金属中含锌,则沉淀 (选填沉淀编号)的质量不为零。
(4)乙同学对甲同学的方案做了如下改进:

与甲同学的方案相比,此方案的优点有 。
(5)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则生成沉淀的物质的量与加入NaOH溶液体积关系的图像正确的是 。

(6)上题中当沉淀质量最大时,溶液呈 (从下列选项中选填,下同);当沉淀只有一种成分时,溶液可能呈 。
A.酸性 B.中性 C.碱性 D.可能酸性,也可能碱性
(6分)人们对酸碱的认识,经历了一个由浅入深.由低级到高级的认识过程。我们目前中学课本中的酸碱理论是1887年阿仑尼乌斯(Arrhenius)提出的电离理论。
(1)1905年富兰克林(Franklin)深入研究了水和液氨的相似性,提出了酸碱溶剂理论。该理论认为:凡能离解而产生溶剂正离子的物质为酸,凡能离解而产生溶剂负离子的物质为碱。已知:H2O+H2O![]() H3O++OH-,则液氨自身电离的方程式为 。
H3O++OH-,则液氨自身电离的方程式为 。
(2)1923年丹麦化学家布朗斯特(Brφusted)和英国化学家劳莱(Lowry)提出了酸碱质子理论。该理论认为:凡是能够释放质子(氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。按质子理论,下列粒子在水溶液既可看作酸又可看作碱的是 。
A.H2O B.NH4+ C.CH3COO- D.Cl- E.HCO3-
(3)1923年路易斯(Lewis)提出酸碱电子理论。该理论认为:凡是能给出电子对而用来形成化学键的物质是碱;凡是能和电子对结合的物质都是酸。如:
酸(电子对接受体) 碱(电子对给予体) 反应产物
H+ + [∶OH ]― ![]() H∶OH
H∶OH
则反应Al3++3H2O![]() Al(OH)3+3H+中的酸是 (填Al3+或H2O)。
Al(OH)3+3H+中的酸是 (填Al3+或H2O)。
现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子(各离子不重复):
阳离子:H+、Na+、Al3+、Ag+、Ba2+ 阴离子:OH-、Cl-、 CO32-、NO3-、SO42-
已知:①A、B两溶液呈碱性,C、D、E溶液呈酸性。
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失。
③D溶液与另外四种溶液反应都能产生沉淀。
请回答下列问题:
(1)写出A与D的化学式: A______________,D_______________。
(2)写出A与E溶液反应的离子方程式:____________________________________。
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1)△H=-akJ·mol-1.请写出表示相同条件下B与C的稀溶液反应的中和热的热化学方程式:________________。
(4)若25℃时,C、E及醋酸三种溶液的pH=4,则E和C溶液中由水电离出的c(H+)的比是_______________;将C与醋酸混合,醋酸的电离程度将____________(填“增大”“不变”或“减小”)(水的浓度视为常数).
(5)用惰性电极电解0.1mol·L-1 D与0.1mol·L-1C各100mL混合后的溶液,电解一段时间后,阴极质量_________(填“增大”“不变”或“减小”,下同);溶液的pH____________.
(6)向(5)中所得溶液中加入足量铁粉,则所能溶解的铁粉质量为___________g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com