
题目列表(包括答案和解析)
(1)加入过量还原铁粉的作用是____________________________。
(2)加入煤油的作用是_____________________________________。
(3)加热煮沸的作用是_____________________________________。
绿色化学提出原子利用率的概念,可表示为:
原子利用率=![]()
现用下列两方法制取![]() :
:
①![]()
②![]()
(1)第①方法中原子利用率为________,第②方法中原子利用率为________.
(2)你认为应该用哪种方法制取![]() ?答:________(填序号).
?答:________(填序号).

| 实验装置 | 实验药品 | 制备原理 | |||||||||
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为 ① (NH4)2SO4+Ca(OH)2
(NH4)2SO4+Ca(OH)2
| ||||||||
| 乙小组 | ② B B |
浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ 氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3?H2O?NH4++OH-向逆方向移动,加快氨气逸出 氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3?H2O?NH4++OH-向逆方向移动,加快氨气逸出 |

| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为 ①______ |
| 乙小组 | ②______ | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③______ |
甲、乙两个研究性学习小组为测定氨分子张氮、氢原子个数比,设计了如下实验流程:

试验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完成后,黑色的氧化铜转化为红色的铜。
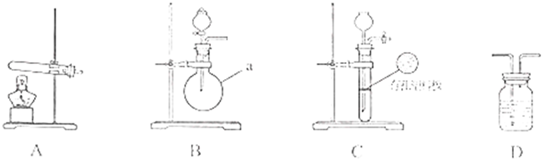
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛,有浓硫酸的洗气瓶。

甲小组测得:反应前氧化铜的质量为![]() 、氧化铜反应后剩余固体的质量为
、氧化铜反应后剩余固体的质量为![]()
![]() 生成氮气在标准状况下的体积
生成氮气在标准状况下的体积![]() 。
。
乙小组测得:洗气前装置D的质量![]() 、洗气后装置后D的质量
、洗气后装置后D的质量![]() 、生成氮气在标准状况下的体积
、生成氮气在标准状况下的体积![]() 。
。
请回答下列问题:
(1)写出仪器a的名称: 。
(2)检查A装置气密性的操作时 。
(3)甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为 ① |
| 乙小组 | ② | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③
|
(4)甲小组用所测数据计算出氨分子中氮、氢的原子个数之比为 。
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比名校小于理论值,其原因是 。 为此,乙小组在原有实验的基础上增加了一个装有药品的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氮气的体积,得出合理的实验结果。该药品的名称是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com