
题目列表(包括答案和解析)
| O | - 3 |
| O | 2- 8 |
| O | - 4 |
| O | 2- 4 |
 +______,
+______,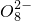 +H2O→Mn
+H2O→Mn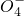 +S
+S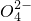 +H+,该反应常用于检验Mn2+的存在.其特征现象是______,?若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为______mol.
+H+,该反应常用于检验Mn2+的存在.其特征现象是______,?若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为______mol. +______,
+______,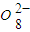 +H2O→Mn
+H2O→Mn +S
+S +H+,该反应常用于检验Mn2+的存在.其特征现象是______,?若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为______mol.
+H+,该反应常用于检验Mn2+的存在.其特征现象是______,?若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为______mol.
(1)上述各步骤中,需用还原剂的是________需用氧化剂的是________.(两空均填编号)
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是________(填化学式).它与NaOH溶液反应的离子方程式是____________________.
(3)配平下列化学方程式,并标出电子转移的方向和数目:
□![]() +□
+□![]() +□
+□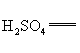 □
□![]() +□
+□![]() +□
+□![]() +□________
+□________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com