
题目列表(包括答案和解析)
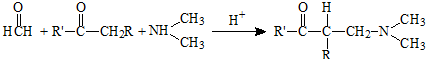
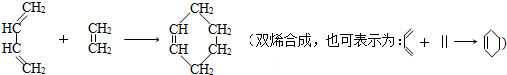
| 乙醚 | 室温 |
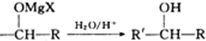 +Mg(OH)X
+Mg(OH)X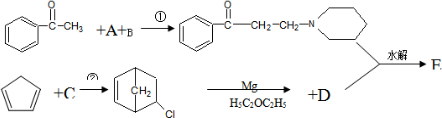
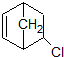 中手性碳原子数为
中手性碳原子数为
(1)写出丙二醇的同分异构体___________(至少写出一种)。
(2)“亮菌甲素”可发生的化学反应类型有_________________(至少写出三种)。
(3)“亮菌甲素”与乙酸和浓硫酸加热可反应生成A,已知A分子可与浓溴水反应生成白色沉淀,写出“亮菌甲素”生成A的化学反应方程式____________。
(4)已知:①0.1 mol二甘醇与足量金属Na反应可生成2.
 是环戊烯的结构简式,可进一步简写为
是环戊烯的结构简式,可进一步简写为 .
.| (1)O3 |
| (2)Zn,H2O |

| (1)O3 |
| (2)Zn,H2O |

 )经O3分解生成的各种产物的结构简式及物质的量之比:
)经O3分解生成的各种产物的结构简式及物质的量之比: 合成己二醛 (
合成己二醛 ( )各步反应的化学方程式:
)各步反应的化学方程式:

 .A经催化加氢得产物B,B的分子式是C10H20,且B内含有六元碳环.写出A和B的结构简式.A:
.A经催化加氢得产物B,B的分子式是C10H20,且B内含有六元碳环.写出A和B的结构简式.A:



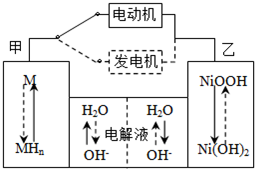
| 放电 | 充电 |
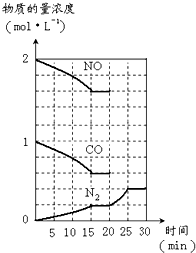
| 结论 | 理由 | |
| ① | ||
| ② | ||
| ③ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com