环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素.
(1)CO的中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白,反应方程式可表示为:CO+Hb?O
2 
O
2+Hb?CO
实验表明,c(Hb?CO)即使只有c(Hb?O
2)的 1/50,也可造成人的智力损伤.
已知t℃时上述反应的平衡常数K=200,吸入肺部O
2的浓度约为1.0×10
-2mol?L
-1,若使c(Hb?CO)小于c(Hb?O
2)的 1/50,则吸入肺部CO的浓度不能超过
1.0×10-6
1.0×10-6
mol?L
-1.
(2)汽车尾气治理的方法之一是在汽车的排气管上安装一个“催化转化器”.
已知反应2NO(g)+2CO(g)

N
2(g)+2CO
2(g)△H=-113kJ?mol
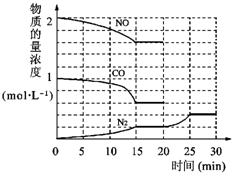
-1①为了模拟催化转化器的工作原理,在t℃时,将2molNO与1mol CO充入lL反应容器中,反应过程中NO(g)、CO(g)、N
2(g)物质的量浓度变化如右下图所示.反应进行到15min时,NO的平均反应速率为
mol?L
-1?min
-1(或0.027mol?L
-1?min
-1)
mol?L
-1?min
-1(或0.027mol?L
-1?min
-1)
,
②观察在20min~30min内N
2(g)发生变化的曲线图,判断引起该变化的条件可能是
b
b
;
a.加入催化剂
b.降低体系温度
c.缩小容器体积为0.5L
d.增加CO
2的物质的量
(3)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.
已知:CO(g)+H
2O(g)

H
2(g)+CO
2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
830 |
1000 |
| 平衡常数K |
10 |
9 |
1 |
0.6 |
试回答下列问题
①上述正向反应是:
放热
放热
反应(填“放热”、“吸热”).
②某温度下上述反应平衡时,恒容、升高温度,正反应速率
增大
增大
(填“增大”、“减小”或“不变”),容器内混合气体的压强
增大
增大
(填“增大”、“减小”或“不变”).
③在830℃发生上述反应,以下表中的物质的量投入恒容反应器,其中向正反应方向移动的有
B、C
B、C
(选填A、B、C、D).
|
A |
B |
C |
D |
| n(CO2) |
3 |
1 |
0 |
1 |
| n(H2) |
2 |
1 |
0 |
1 |
| n(CO) |
1 |
2 |
3 |
0.5 |
| n(H2O) |
5 |
2 |
3 |
2 |

 环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素.
环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素. O2+Hb?CO
O2+Hb?CO N2(g)+2CO2(g)△H=-113kJ?mol-1
N2(g)+2CO2(g)△H=-113kJ?mol-1 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表: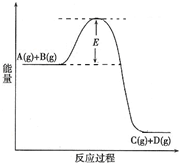 (2010?陕西模拟)已知A(g)+B(g)?C(g)+D(g) 反应过程中的能量变化如图所示,回答下列问题.
(2010?陕西模拟)已知A(g)+B(g)?C(g)+D(g) 反应过程中的能量变化如图所示,回答下列问题.