无焰食品加热器常被士兵用于野外加热食物,它的成分是镁粉、铁粉、氯化钠.使用时加入水,热量是由镁和水反应产生的,1.0g镁和水反应放出热量14.7kJ.下面是对该产品的实验研究:
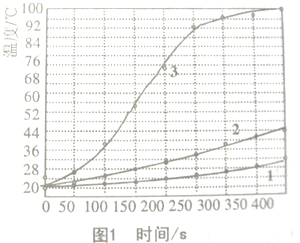
实验1.室温下将1.0mol镁条、0.10mol铁粉和0.10mol的氯化钠加入隔热容器的水中,连续搅拌,每50s记录一次温度在图1上(曲线1),再把1.0mol镁条分成100份(曲线2)和1.0mol镁粉(曲线3)代替镁条重复以上实验.
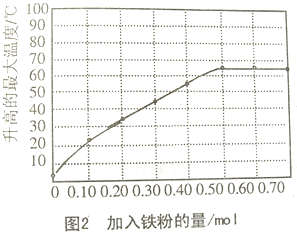
实验2.把0.10mol镁粉和0.10mol氯化钠混合,常温下放入隔热容器的100mL水中,不断搅拌,15min时记录温度,铁粉用量不同时温度变化情况如图2所示
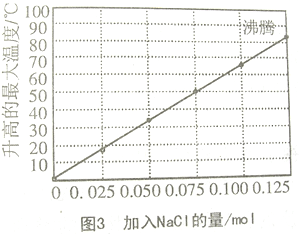
实验3.把0.10mol镁粉和0.50mol铁粉混合加入隔热容器的100mL水中,不断搅拌,15min时记录温度,氯化钠用量不同时温度变化情况如图3所示.
请回答:
(1)实验1可以发现影响镁和水反应速率的因素是
A.反应温度 B.NaCl的量 C.铁的量 D.镁的反应表面积
(2)实验3中大于0.125molNaCl的用量的实验就不再做的原因是
A.加入更多NaCl不再增加反应速率 B.加入NaCl会降低反应速率
C.已达到沸点不会再有温度变化 D.需要加入更多的铁粉提高温度
(3)如果在实验3中加入了0.060mol的NaCl,混合物的温度最接近
A.34℃B.42℃C.50℃D.62℃
(4)一位工程师在设计无焰食物加热器时,希望用尽可能少的物料产生尽可能多的热量.根据以上实验应选择的组合是
A.0.50mol的铁粉、0.125molNaCl和0.10mol的镁粉
B.0.50mol的铁粉、0.125molNaCl和0.10mol的镁条
C.0.70mol的铁粉、0.125molNaCl和0.10mol的镁粉
D.0.70mol的铁粉、0.125molNaCl和0.10mol的镁条
(5)写出该无焰加热器反应的热化学方程式
;
(6)你认为铁粉、NaCl为什么会使反应速率增大?
.



