
题目列表(包括答案和解析)
(14分)(Ⅰ)、A、B、C、D、E、五种元素均是短周期元素,且原子序数依次增大。B、E原子的最外层电子数均为其电子层数的2倍。D、E元素原子的最外层电子数相等。X、Y、Z、W、G、甲、乙七种物质均由上述中的两种或三种元素组成。元素B形成的单质M与甲、乙(相对分子质量:甲<乙)浓溶液的反应分别是:甲与M反应生成X、Y、Z,乙与M反应生成Y、Z、W,反应条件均省略。回答下列有关问题:
⑴X、Y、W均能与Z反应,若将标准状况下的X和D2按4:1充满试管后将其倒立于水槽中,待水不在上升时,试管内溶质的物质的量浓度是 (假设溶质不扩散)
⑵若将X、W、D2按4:4:3通入Z中充分反应,写出总的离子方程式
⑶G是一种既能与强酸又能与强碱反应的酸式盐,则G的电子式 ,取0.2mol/L的NaOH溶液与0.1mol/L的G溶液等体积混合后,加热至充分反应后,待恢复至室温剩余溶液中离子浓度的由大到小顺序是 ,此时测得溶液的PH=12,则此条件下G中阴离子的电离平衡常数Ka =
(Ⅱ)⑷某温度时,向AgNO3溶液中加入K2CrO4溶液会生成
Ag2CrO4沉淀,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。
该温度下,下列说法正确的是_________。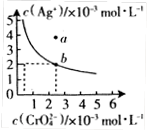
A. Ag2CrO4的溶度积常数(Ksp)为1×10-8
B. 含有大量CrO 的溶液中一定不存在Ag+
的溶液中一定不存在Ag+
C. a点表示Ag2CrO4的不饱和溶液,蒸发可以使溶液由a点变到b点
D. 0.02mol·L-1的AgNO3溶液与0.02mol·L-1的Na2CrO4溶液等体积混合会生成沉淀
⑸若常温下Ksp[Cr(OH)3]=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应调至_______。

 的溶液中一定不存在Ag+
的溶液中一定不存在Ag+A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C和D的最外层电子数之和为11,C、D、F三种元素的原子序数之和为28。请回答下列问题:
(1)B与D可形成非极性分子X,过量的X与F D2-溶液反应的离子方程式为____________________________。
(2)E、F、H所形成的简单离子的半径由大到小的顺序为(用离子符号表示) 。
(3)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(4)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如右图所示。写出石墨(I)电极上发生的电极反应式: 。
(5)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为______。
(6)由A、C、D、E四种元素中任意三种构成的强电解质Z和W,溶于水时都能促进水的电离,测得Z的水溶液pH>7,W的水溶液pH<7,则Z为 、W为 。
(7)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g)![]() 2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol, A2 0.5mol, CA30mol
B.C2 0mol, A2 0mol, CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L, CA3 0.1mol/L
②求算此平衡体系的平衡常数K=________;
 2CA3(g)
2CA3(g)| 1.00 |
| 0.9 |
| c2(NH3) |
| c(N2)×c3(H2) |
(
| ||||
(
|
| 1.00 |
| 0.9 |
| c2(NH3) |
| c(N2)×c3(H2) |
(
| ||||
(
|


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com