
题目列表(包括答案和解析)
工业上制氯乙烯需要以下反应:(1)乙炔与氯化氢制氯乙烯(2)高温煅烧石灰石(3)电解饱和食盐水(4)制乙炔(5)制乙烯(6)合成氯化氢(7)制水煤气(8)制盐酸(9)制电石,则制氯乙烯的正确操作顺序是
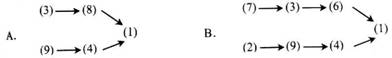
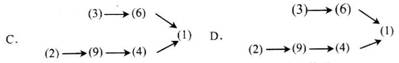
①乙炔与氯化氢制氯乙烯 ②高温煅烧石灰石③电解饱和食盐水
(2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑) ④制乙炔 ⑤制乙烯 ⑥合成氯化氢 ⑦制水煤气 ⑧制盐酸 ⑨制电石
2NaOH+H2↑+Cl2↑) ④制乙炔 ⑤制乙烯 ⑥合成氯化氢 ⑦制水煤气 ⑧制盐酸 ⑨制电石
则制氯乙烯的正确操作顺序是( )
(本题共12分)
氯气和氯乙烯都是重要的化工产品,年产量均在107t左右。氯气的实验室制备和氯乙烯的工业生产都有多种不同方法。
完成下列填空:
(1)实验室制取纯净的氯气,除了二氧化锰、浓盐酸和浓硫酸,还需要_________、________(填写试剂或溶液名称)
(2)实验室用2.00mol/L的盐酸和漂粉精[成分为Ca(ClO)2、CaCl2]反应生成氯气、氯化钙和水,若产生2.24L(标准状况)氯气,发生反应的盐酸为_________m,l。
(3)实验室通常用向上排空气法收集氯气。设计一个简单实验,验证所收集的氯气中是否含有空气。
_________________
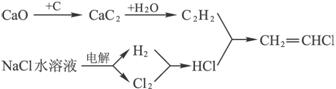
4)工业上用电石-乙炔法生产乙烯的反应如下:
CaO+3C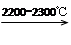 CaC2+CO
CaC2+CO
CaC2+2H2O→HC≡CH↑+Ca(OH)2
HC≡CH↑+HCl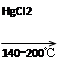 CH2=CHCl
CH2=CHCl
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖于石油资源。
电石-乙炔法的缺点是___________________、_____________________。
(5)乙烷和氯气反应可制得ClCH2CH2Cl,ClCH2CH2Cl加热分解得到氯乙烯和氯化氢。设计一种以乙烯和氯气为原料制取氯乙烯的方案(其他原料自选),用化学方程式表示(不必注明反应条件)。
要求:①反应产生的氯化氢必须用于氯乙烯的制备;②不再产生其他废液。
___________________________________
 CaC2+CO
CaC2+CO CH2=CHCl
CH2=CHCl利用化学原理可以对工厂排放的废水进行有效检测和合理处理。
(1)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润红色石蕊试纸变蓝的气体)。除去NO2-离子的离子方程式是
▲ 。
(2)废水中的N、P元素是造成水体富营养化的主要因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去。
①方法一:将Ca(OH)2或CaO投加到待处理的废水中,生成磷酸钙,从而进行回收。当处理后的废水中c(Ca2+)=2×10-7mol/L时,溶液中c(PO43-)= ▲
(已知常温时,KSP[Ca3(PO4)2]=2×10-33)
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石——鸟粪石,反应的方程式为Mg2++ NH4++PO43-= MgNH4 PO4。该方法中需要控制污水的pH为7.5-10,若pH高于10.7,鸟粪石的产量会大大降低。其原因可能是 ▲ 。与方法一相比,方法二的优点是 ▲ 。
(3)三氯乙烯在印刷、纺织等行业应用广泛,为了减少其对环境的影响,可将三氯乙烯在二氧化钛薄膜上催化降解,其反应的机理如下:

该反应的总化学方程式为 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com