
题目列表(包括答案和解析)
(1)浓度均为0.1 mol/L的8种溶液:
①HNO3
②H2SO4
③CH3COOH
④Ba(OH)2
⑤NaOH
⑥CH3COONa
⑦KCl
⑧NH4Cl,溶液pH值由小到大的顺序是(填写编号)________.
(2)氯化铝水溶液呈________性,原因是(用离子方程式表示):________,把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是________(写化学式).
A、B、C、D分别是HNO3、Ba(NO3)2、NH4Cl、NaOH四种溶液中的一种。欲将它们一一鉴别,甲、乙、丙分别提出如下方案,请回答有关问题:
(1)甲同学用物质X一次性鉴别上述四种物质,他将适量的X溶液分别加入到四种溶液中,结果发现:C溶液变为棕黄色;B溶液中有白色沉淀产生;D溶液中有能使湿润的红色石蕊试纸变蓝的气体产生,同时产生白色沉淀,最终变为红褐色。
B的化学式是________;D的电子式是________;X的化学式是________;A溶液中水的电离程度________(填“大于”、“小于”或“等于”)C溶液中水的电离程度。
(2)乙同学提出用明矾来鉴别上述四种物质,写出能检验出NH4Cl溶液所涉及的所有离子方程式:Ba2++SO42-=BaSO4↓、________________________。
(3)丙同学用MgSO4来鉴别上述四种溶液,在生成的白色沉淀Mg(OH)2中分别加入HNO3和NH4Cl溶液时,发现沉淀均溶解。有以下两种解释,同时提供下表数据:
A.NH4Cl溶液能使Mg(OH)2溶解,主要是NH4+水解产生H+的缘故。
B.NH4Cl溶液能使Mg(OH)2溶解,主要是NH4+结合OH-的缘故。
| 0.01 mol·L-1 电解质溶液 | HF | CH3COOH | HCN | NH3·H2O |
| 酸中H+或碱 中OH-的浓度/mol·L-1 | 8.00×10-4 | 1.32×10-4 | 1.00×10-4 | 1.33×10-4 |
(8分)黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀至 2.12 L时测得其pH=0;将稀释后的溶液分为两等份,向其中一份溶液中滴加浓度为6. 05 mol/L的NaOH溶液,向另一份溶液中滴加0.600 mol/L Ba(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶液的体积变化如下图所示:
(1)请通过计算确定:m=________。
(2)X的摩尔质量为368 g/mol,则X的化学式为________________。
(3)将一定质量的Fe、Cu的混合物平均分成四等份,每份13.2 g,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO):
| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属质量/g | 9.0 | 4.8 | 0 | 0 |
| NO体积/L | 1.12 | 2.24 | 3.36 | V |
回答下列问题:
①写出实验①中发生反应的离子方程式___________________________________。
②实验④中V=________。
(8分)黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀至 2.12 L时测得其pH=0;将稀释后的溶液分为两等份,向其中一份溶液中滴加浓度为6. 05 mol/L的NaOH溶液,向另一份溶液中滴加0.600 mol/LBa(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶
05 mol/L的NaOH溶液,向另一份溶液中滴加0.600 mol/LBa(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶 液的体积变化如下图所示:
液的体积变化如下图所示: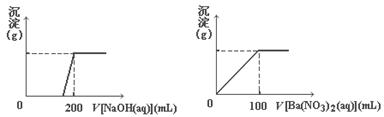
(1)请通过计算确定:m=________。
(2)X的摩尔质量为368 g/mol,则X的化学式为________________。
(3)将一定质量的Fe、Cu的混合物平均分成四等份,每份13.2 g,分别加入同浓度的稀硝酸 ,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO):
,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO):
| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属质量/g | 9.0 | 4.8 | 0 | 0 |
| NO体积/L | 1.12 | 2.24 | 3.36 | V |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com