
题目列表(包括答案和解析)
镁条在空气中燃烧,其反应的化学程式是 、 、 ;
 某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究.
某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究.| 实验操作 | 实验现象 | |
| 方案一 | 取已除去表面氧化膜的镁条和铝条, 分别和0.1mol?L-1HCl溶液反应 |
均有气泡产生,镁条反应 比铝条反应更剧烈 |
| 方案二 |
 某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究.
某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究.| 实验操作 | 实验现象 | |
| 方案一 | 取已除去表面氧化膜的镁条和铝条, 分别和0.1mol?L-1HCl溶液反应 | 均有气泡产生,镁条反应 比铝条反应更剧烈 |
| 方案二 |

某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究。
步骤1:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、胶塞等装配如图所示的装置。另准备一只胶塞,其中有一根铜丝穿过,铜丝末端固定一根镁条备用。
步骤2:引燃燃烧匙中的试剂,塞好瓶塞。燃烧结束后,调节广口瓶内外液面相平。
步骤3:点燃镁条,更换胶塞,镁条继续燃烧,反应结束后,广口瓶内水面上升。
步骤4:取蒸发皿中得到的固体,加盐酸溶解。向溶液中加入过量氢氧化钠溶液,有白色沉淀生成,同时得到一种能使湿润红色石蕊试纸变蓝的气体。
⑴为除去广口瓶中的氧气,燃烧匙中应装入下列试剂中的 ▲ (填序号)。
A.炭粉 B.硫粉 C.红磷
⑵“步骤2”中调节内外液面相平的方法: ▲ 。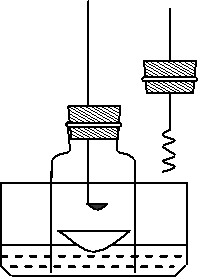
⑶写出Mg3N2溶于足量盐酸生成两种氯化物的化学方程式: ▲ 。
⑷某同学直接将镁条在空气中点燃,并将所得白色固体进行“步骤4”的实验,结果无气体生成,其原因是 ▲ 。
⑸兴趣小组同学为比较镁和铝的金属性强弱,设计了下表中的实验方案一,请你再设计一种不同的实验方案。
实验试剂和用品:镁条、铝条、0.1mol/L MgCl2溶液、0.1mol/L AlCl3溶液、0.1mol/L HCl溶液、 0.1mol/L NaOH溶液、pH试纸(其他实验仪器可任选)
实验操作 | 实验现象 | |
方案一 | 取已除去表面氧化膜的镁条和铝条,分别和0.1mol/L HCl溶液反应 | 均有气泡产生,镁条反应比铝条反应更剧烈 |
方案二 | ▲ | ▲ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com