
题目列表(包括答案和解析)
(10分)已知NO2转化为N2O4的反应是放热反应且是可逆反应:2NO2 (g) N2O4(g)。如下图1所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间用止水夹K夹紧,烧杯甲、乙分别盛放100mL冷水和热水。
N2O4(g)。如下图1所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间用止水夹K夹紧,烧杯甲、乙分别盛放100mL冷水和热水。

图1 图2
(1)图1中___________瓶中气体颜色更深?(填“A”或“B”)。请比较平衡时反应速率:A瓶__________B瓶;(填“>”“<”或“=”)
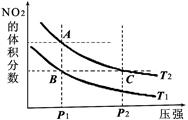
(2)在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如上图2所示。请比较图2中A、B两点混合气体的平均相对分子质量:A点_________B点。(填“>”“<”或“="”" )
(3)平衡常数定义为一定条件下,可逆反应平衡时产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积比。即aA(g)+bB(g) pC(g)+qD(g)中K=
pC(g)+qD(g)中K= 
下如:N2(g)+3H2(g) 2NH3(g)的平衡常数表示式K=
2NH3(g)的平衡常数表示式K=
①2NO2 (g) N2O4(g)的平衡常数表达式K=
N2O4(g)的平衡常数表达式K=
②平衡常数K的具体值会随温度而改变。请比较上图2中A点和B点所对应的平衡常数数值。A点____________B点(填“>”“<”或“=”)。
对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是
①生成物的百分含量一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥使用了适宜的催化剂
A.②⑤ B.①② C.③⑤ D.④⑥
(10分)已知NO2转化为N2O4的反应是放热反应且是可逆反应:2NO2 (g) N2O4(g)。如下图1所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间用止水夹K夹紧,烧杯甲、乙分别盛放100mL冷水和热水。
N2O4(g)。如下图1所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间用止水夹K夹紧,烧杯甲、乙分别盛放100mL冷水和热水。


图1
图2
(1)图1中___________瓶中气体颜色更深?(填“A”或“B”)。请比较平衡时反应速率:A瓶__________B瓶;(填“>”“<”或“=”)
(2)在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如上图2所示。请比较图2中A、B两点混合气体的平均相对分子质量:A点_________B点。(填“>”“<”或“=” )
(3)平衡常数定义为一定条件下,可逆反应平衡时产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积比。 即aA(g)+bB(g) pC(g)+qD(g)中K=
pC(g)+qD(g)中K= 
下如:N2(g)+3H2 (g) 2NH3 (g)的平衡常数表示式K=
2NH3 (g)的平衡常数表示式K=
①2NO2 (g) N2O4(g)的平衡常数表达式K=
N2O4(g)的平衡常数表达式K=
②平衡常数K的具体值会随温度而改变。请比较上图2中A点和B点所对应的平衡常数数值。A点____________B点(填“>”“<”或“=”)。
对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是
①生成物的百分含量一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥使用了适宜的催化剂
A.②⑤ B.①② C.③⑤ D.④⑥
 N2O4(g)。如下图1所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间用止水夹K夹紧,烧杯甲、乙分别盛放100mL冷水和热水。
N2O4(g)。如下图1所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间用止水夹K夹紧,烧杯甲、乙分别盛放100mL冷水和热水。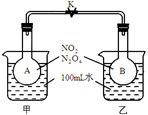
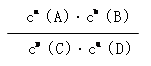
 pC(g)+qD(g)中K=
pC(g)+qD(g)中K= 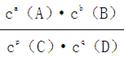
 2NH3(g)的平衡常数表示式K=
2NH3(g)的平衡常数表示式K=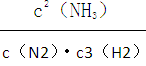
 N2O4(g)的平衡常数表达式K=
N2O4(g)的平衡常数表达式K= 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com