
题目列表(包括答案和解析)
| A、高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” | B、焰火与焰色反应知识有关,所有金属及其化合物灼烧时火焰均呈现特殊颜色 | C、2010年支援舟曲灾区的生活用品中食醋、纯碱、食盐的主要化学物质分别属于酸、碱、盐 | D、丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应 |
 (2013?东城区二模)已知:
(2013?东城区二模)已知: 是碳酸甲乙酯的工业生产原理.如图是投料比[
是碳酸甲乙酯的工业生产原理.如图是投料比[ ]分别为3:1和1:1、反应物的总物质的量相同时,
]分别为3:1和1:1、反应物的总物质的量相同时,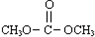 的平衡转化率与温度的关系曲线.下列说法正确的是( )
的平衡转化率与温度的关系曲线.下列说法正确的是( )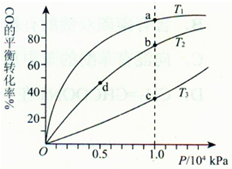 用CO合成甲醇的化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
用CO合成甲醇的化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )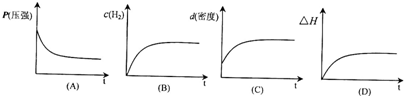
| [HCOO-] | [HCOOH]?[OH-] |
| A、容器Ⅰ、Ⅱ中正反应速率相同 | B、容器Ⅰ、Ⅲ中反应的平衡常数相同 | C、容器Ⅰ中CO的物质的量比容器Ⅱ中的多 | D、容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和等于1 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com