
题目列表(包括答案和解析)
| c(b-a) |
| 25 |
| c(b-a) |
| 25 |
| 16c(b-a) |
| m |
| 16c(b-a) |
| m |
(A)【物质结构与性质】
有A、B、C、D、E、F六种元素,B原子得到一个电子后3p轨道全充满,A+比B原子形成的离子少一个电子层;C原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的;D和E是位于同一主族的短周期元素,E元素的最高化合价和最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%;F元素的核电荷数为26。
请回答下列问题:
(1)A元素位于元素周期表中第_________周期第_________族;F元素基态原子形成的+2价阳离子的电子排布式为_________。
(2)C与B形成的CB3分子中C原子的杂化方式是_______,其分子的空间形状是_______。
(3)另一元素X与A同主族,其第一电离能小于A,晶体XB与AB熔点较高的是_________,其理由是_______________________________________________________________。
(4)1 mol ED晶体中含有的E—D共价键的数目是_________。
(B)【实验化学】
阿司匹林(乙酰水杨酸)是由水杨酸和乙酸酐合成的:

在生成乙酰水杨酸的同时,水杨酸分子之间也能发生聚合反应,生成少量聚合物(副产物)。合成乙酰水杨酸的实验步骤如下:
①向150 mL干燥锥形瓶中加入
②减压过滤,用滤液淋洗锥形瓶,直至所有晶体收集到布氏漏斗中。抽滤时用少量冷水洗涤晶体几次,继续抽滤,尽量将溶剂抽干。然后将粗产品转移至表面皿上,在空气中风干。
③将粗产品置于100 mL烧杯中,搅拌并缓慢加入25 mL 饱和碳酸氢钠溶液,加完后继续搅拌2—3 min,直到没有二氧化碳气体产生为止。过滤,用5—10 mL蒸馏水洗涤沉淀。合并滤液于烧杯中,不断搅拌,慢慢加入15 mL 4 mol·L-1盐酸,将烧杯置于冰水中冷却,即有晶体析出。抽滤,用冷水洗涤晶体1—2次,再抽干水分,即得产品。
请回答下列问题:
(1)第①步中,要控制温度在85—
(2)在第②步中,用冷水洗涤晶体,其目的是_________________________________________、__________________________________________。
(3)在第③步中,加入饱和碳酸氢钠溶液的作用是___________________________________,加入盐酸的作用是________________________________________。
(4)如何检验产品中是否混有水杨酸?___________________________________________
____________________________________________________________________。
(A)HN3称为叠氮酸,常温下为无色有刺激性气味的液体。![]() 也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:
也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:
NaNH2+N2O![]() NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成
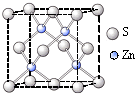
NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成![]() 。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试回答下列问题:
。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试回答下列问题:

(1)基态氮原子核外电子排布的轨道表示式为_____________。
(2)元素N、S、P的第一电离能(I1)由大到小的顺序为_____________。
(3)HN3属于_____________晶体,![]() 的空间构型是_____________,与
的空间构型是_____________,与![]() 互为等电子体的分子的化学式为_____________(写1种)。
互为等电子体的分子的化学式为_____________(写1种)。![]() 的电子式为____________,其中心原子的杂化类型是____________。
的电子式为____________,其中心原子的杂化类型是____________。
(4)![]() 中的键型为___________,超导氧化物A的化学式为___________。
中的键型为___________,超导氧化物A的化学式为___________。
(5)治癌药物B的结构简式为___________。
(B)以下是以绿矾、碳酸氢铵和氯化钾为原料制备生产市场较紧俏的硫酸钾产品的新工艺。已知:反应(Ⅰ)的化学方程式为:FeSO4·7H2O+2NH4HCO3![]() FeCO3↓+(NH4)2SO4+CO2↑+H2O
FeCO3↓+(NH4)2SO4+CO2↑+H2O
反应(Ⅱ)的化学方程式为:(NH4)2SO4+2KCl![]() K2SO4+2NH4Cl
K2SO4+2NH4Cl
工艺流程如下:

试回答下列问题:
(1)该工艺中的副产品是____________。(填化学式)
(2)操作C的名称为____________。
(3)原料绿矾、碳酸氢铵的最佳投料比是____________(质量比)时,FeSO4的转化率大于95%。
(4)物质甲是____________(填化学式),反应(Ⅲ)是甲物质与适量空气煅烧,温度为700—
A和B两种物质的分子式都是C7H6O2,它们都能跟氢氧化钠溶液发生反应,A能发生银镜反应而B不能,A还能与溴水反应,1molA与足量溴水反应时消耗2mol Br2 ,B能与碳酸氢钠溶液反应放出CO2 。由A转化为B的过程可表示如下:

试回答下列问题:
(1)写出有机物的结构简式:C 、D ;
(2)写出化学反应方程式:
A与溴水的反应:
B与E在浓硫酸存在下的反应:
(3)在A转化为B的过程中第④步反应若溴水足量,再进行第⑤步反应,则生成的产物中可能含有碳碳叁键,试写出其含有碳碳叁键的物质的结构简式(有几种写几种) 。
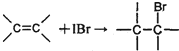
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com