
题目列表(包括答案和解析)
(12分)高锰酸钾是深紫色的针状晶体,是最重要也是最常用的氧化剂之一,可用来漂白棉、毛、丝等纺织品。已知温度高于80℃高锰酸钾会部分分解
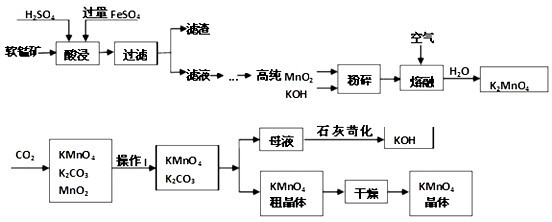
实验室以软锰矿(主要成份是MnO2)为主要原料来制备高锰酸钾,分两步进行:
第一步是将+4价的锰氧化成为+6价,反应方程式为:
![]()
第二步是在通入CO2条件下使+6价的锰歧化为+7价和+4价(MnO2)。
实验流程如下: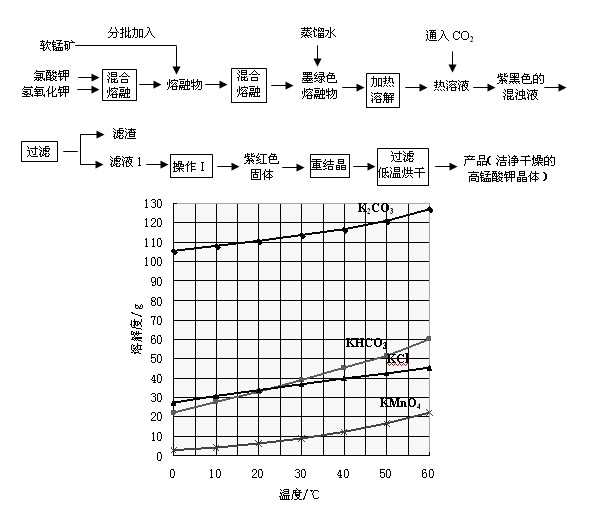
几种物质的溶解度随温度变化如上图所示。回答下列问题:
(1)下列仪器中,混合熔融氯酸钾和氢氧化钾固体过程中需要用到的是
A.蒸发皿 B.玻璃棒 C.铁棒 D.坩埚 E.泥三角 F.烧杯 G.酒精灯 H.铁坩埚
![]()
(2)通入适量二氧化碳,锰酸钾发生岐化反应的化学方程式是
![]()
(3)通入适量的二氧化碳直到锰酸钾全部岐化为止(可用玻璃棒蘸取溶液点于滤纸上,如果滤纸上只有紫红色而无绿色
痕迹,即表示锰酸钾已歧化完全),二氧化碳的通入量不能过多的原因是 。
![]()
(4)操作Ⅰ应该在 (填“加压”、“减压”、“常压”)情况下蒸发,其理由是 。(5)除了酸化可以使锰酸钾发生岐化反应生成高锰酸钾外(歧化法),通过使用惰性电极电解锰酸钾溶液也可以制备高锰酸钾。电解时阴极有气泡产生,则阳极的电极反为 。
与歧化法相比,电解法主要的优点是 。

| 2 |
| 3 |
| 2 |
| 3 |
| ||
| ||
| 0.54g |
| 56+35.5x |
| 0.54g |
| 56+35.5x |
(1)下列实验设计或操作均有不妥之处,其中存在安全隐患或可能产生安全事故的是_______。
①直接点燃未检验纯度的CO
②石油分馏实验时,不加沸石直接加热蒸馏
③用混有炭粉的二氧化锰与氯酸钾混合加热制氧气
④在稀释浓硫酸时,将水直接倒入浓硫酸中
⑤制Cl2用1 mol·L-1盐酸与MnO2作用
(2)已知KMnO4(158.0 g·mol-1)可将草酸根离子完全氧化成二氧化碳,因此草酸根离子常被用以测定高锰酸钾溶液的浓度:

![]() +
+![]() +16H+
+16H+![]() 2Mn2++10CO2↑+8H2O,现称取0.670 0 g的草酸钠(134.0 g·mol-1)溶于约30 mL水中,加入10 mL稀硫酸(3 mol·L-1)后趁热以高锰酸钾溶液滴定。试完成下列问题:
2Mn2++10CO2↑+8H2O,现称取0.670 0 g的草酸钠(134.0 g·mol-1)溶于约30 mL水中,加入10 mL稀硫酸(3 mol·L-1)后趁热以高锰酸钾溶液滴定。试完成下列问题:
①滴定时KMnO4溶液应盛放在_________滴定管中,测定后的溶液应保存在_________试剂瓶中(填:“棕色”或“无色”)。
②如何判断恰好完全反应____________________。
③开始时滴定管液面恰好处于“0”刻度处(此滴定管最小刻度为0.1 mL),到滴定终点时,处于图示位置,体积读数为: _________mL;根据以上数据计算出KMnO4溶液物质的量浓度为_________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com