
题目列表(包括答案和解析)
下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。下列说法中不正确的是:
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质:
【解析】若F是硫酸,则E是SO3,D是SO2,C是单质硫,则A可以是Na2S,B是硫化氢,A正确。当X是强碱时,A、B、C、D、E、F可以分别是NH4NO3、NH3、N2、NO、NO2、HNO3,B正确。氯气具有强氧化性,而C又是单质,所以反应一定氧化还原反应。所以选项D是错误的,答案选D。
下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。下列说法中不正确的是:
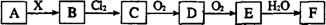
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质:
【解析】若F是硫酸,则E是SO3,D是SO2,C是单质硫,则A可以是Na2S,B是硫化氢,A正确。当X是强碱时,A、B、C、D、E、F可以分别是NH4NO3、NH3、N2、NO、NO2、HNO3,B正确。氯气具有强氧化性,而C又是单质,所以反应一定氧化还原反应。所以选项D是错误的,答案选D。
有下列三种制取氯气的方法:①实验室用二氧化锰跟浓盐酸反应制取氯气;②KMnO4是一种常用的氧化剂.在酸性条件下,可用高锰酸钾跟浓盐酸在室温下制氯气,其中![]() 被还原成Mn2+;③历史上曾用“地康法”制氯气,是用CuCl2作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气.比较以上三个反应,下列说法不正确的是
被还原成Mn2+;③历史上曾用“地康法”制氯气,是用CuCl2作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气.比较以上三个反应,下列说法不正确的是
[ ]
A.三个反应中,HCl均是还原剂,Cl2为氧化产物
B.三个反应中,可以判断氧化能力从强到弱顺序为KMnO4>MnO2>O2
C.用三种方法制取1mol氯气,转移电子数目相等
D.等物质的量的二氧化锰、高锰酸钾、氧气与足量HCl反应,生成Cl2的物质的量相等
(14分)
含硫化合物在工业生产中有广泛的用途。
(1)对于可逆反应2SO2(g)+O2(g)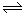 2SO3(g) △H<0,下列研究目的和图示相符的是
2SO3(g) △H<0,下列研究目的和图示相符的是
(填序号)
| 序号 | A | B | C | D |
| 目的 | 压强对平衡的影响 | 温度对转化率的影响 | 增加O2浓度对速率的影响 | 浓度对平衡常数的影响 |
| 图示 |  |  | 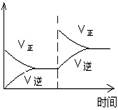 | 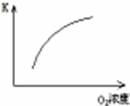 |
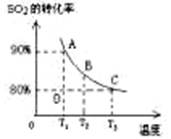
 2SO3(g) △H<0,下列研究目的和图示相符的是
2SO3(g) △H<0,下列研究目的和图示相符的是 | 序号 | A | B | C | D |
| 目的 | 压强对平衡的影响 | 温度对转化率的影响 | 增加O2浓度对速率的影响 | 浓度对平衡常数的影响 |
| 图示 |  |  |  | 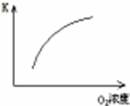 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com