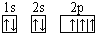
A、B、C、D四种短周期元素原子序数依次增大,A元素原子的价电子排列为ns
2np
2,B元素的最外层电子数是其电子层数的3倍,E元素原子的价电子排布为3d
64s
2.C、D的电离能数据如下(kJ?mol
-1):
|
I1 |
I2 |
I3 |
I4 |
| C |
738 |
1451 |
7733 |
10540 |
| D |
577 |
1817 |
2745 |
11578 |
(1)化合价是元素的一种性质.由C、D的电离能数据判断,C通常显
+2
+2
价,D显
+3
+3
价;
(2)某单质甲分子与化合物AB分子中电子总数相等,则甲分子中包含
1
1
个σ键,
2
2
个π键;
(3)AB的总键能大于甲的总键能,但AB比甲容易参加化学反应.根据下表数据,说明AB比甲活泼的原因是
断裂C≡O中的一个π键消耗的能量是273kJ/mol,断裂N≡N中的一个π键消耗的能量是523.3kJ/mol,断裂一个π键CO比N2更容易,所以CO更活泼
断裂C≡O中的一个π键消耗的能量是273kJ/mol,断裂N≡N中的一个π键消耗的能量是523.3kJ/mol,断裂一个π键CO比N2更容易,所以CO更活泼
.
|
单键 |
双键 |
叁键 |
| AB |
键能(kJ?mol-1) |
357.7 |
798.9 |
1071.9 |
| 甲 |
键能(kJ?mol-1) |
154.8 |
418.4 |
941.7 |
(4)E能与AB形成配合物,其中E提供
空轨道
空轨道
,AB提供
孤对电子
孤对电子
.
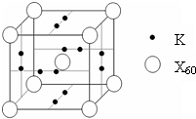
(5)如图所示晶胞中,阳离子与阴离子的个数为
3:1
3:1
.

 A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.己知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.
A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.己知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质. 2NH3△H=-92.4kJ?mol-1
2NH3△H=-92.4kJ?mol-1 (4)E能与AB形成配合物,其中E提供
(4)E能与AB形成配合物,其中E提供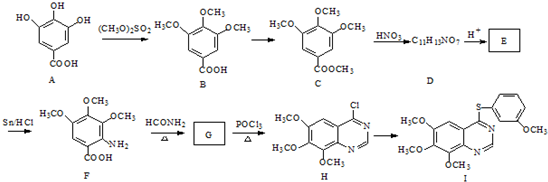

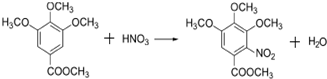





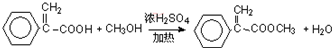
 .合成过程中无机试剂任选;合成路线流程图示例为:
.合成过程中无机试剂任选;合成路线流程图示例为:
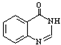
 ; ②
; ②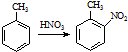 ;③
;③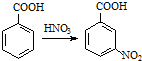


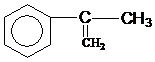 出发来合成A,合成路线如下:
出发来合成A,合成路线如下: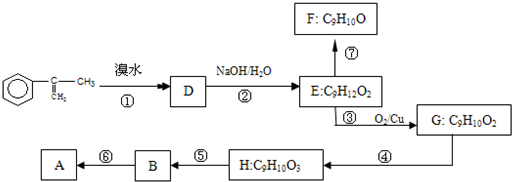

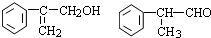
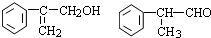
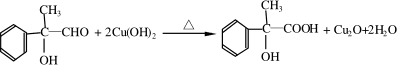



 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: