
题目列表(包括答案和解析)
 (2010?桂林二模)某课外实验小组设计了如图所示装置进行“一器多用”的实验探究(夹持装置已略去).
(2010?桂林二模)某课外实验小组设计了如图所示装置进行“一器多用”的实验探究(夹持装置已略去).| 编号 | 实验操作 | 实验现象与结论 |
| ① | 取少量粉末放入试管中,注入1mol/L的硫酸 | 粉末逐渐溶解,溶液呈黄绿色 |
| ② | 将“①”中所得溶液分成两份;向其中一份滴加几滴KSCN溶液,振荡 | 若溶液变为 血红色 血红色 ,说明有Fe2O3存在 |
| ③ | 在另一份中加入少量KMnO4溶液 | 若溶液 紫色褪去 紫色褪去 ,说明有FeO存在 |
| 浓硫酸 |
| △ |

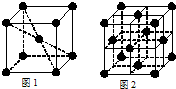 (2010?漳州二模)[化学---物质结构与性质]研究物质的微观结构,有助于人们理解物质变化的本质.请回答下列问题.
(2010?漳州二模)[化学---物质结构与性质]研究物质的微观结构,有助于人们理解物质变化的本质.请回答下列问题.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com