
题目列表(包括答案和解析)
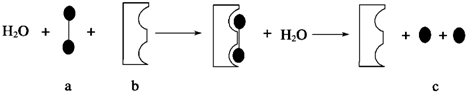
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增。B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3P轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体。根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为 (用元素符号表示)。
(2)化合物BD3的分子空间构型是 。
(3)上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED),其材料是E与F形成的化合物甲(属于第三代半导体),用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%。化合物甲的晶胞结构如右图(白球代表F,黑球代表E)。试回答:
①该晶胞中所包含的F原子(白色球)个数为 。
②与同一个E原子相连的F原子构成的空间构型为 。
③下列说法正确的是 。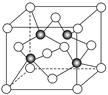
A.该晶胞结构与NaCl相同 B.半导体EB与EF互为等电子体
C.电负性:F>E D.EF晶体中含有配位键
④ (CH3)3E中E原子的杂化方式为 。
⑤该晶体中紧邻的F原子之间与紧邻的F、E两原子之间距离的比值为
(写出计算过程)
已知,铁有α、γ、δ三种晶体结构,并且在一定条件下可以相互转化(如图),请回答相关的问题:


α-Fe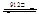 γ-Fe
γ-Fe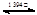 δ-Fe
δ-Fe
(1)铁的三种晶体之间的转化属于 变化(填“物理”或“化学”),理由是: 。
(2)铁的α、γ、δ三种晶体结构中,Fe原子的配位数之比为: 。
(3)设α-Fe晶胞边长为a cm,δ-Fe晶胞边长为b cm,计算确定:
两种晶体的密度比为: 。(用a、b的代数式表示)
(4)Fe3C是工业炼铁生产过程中产生的一种铁的合金,在Fe3C晶体中,每个碳原子被6个位于顶角位置的铁原子所包围,成八面体结构,即碳原子配位数为6,那么,铁原子配位数为 。
事实上,Fe3C是C与铁的晶体在高温下形成的间隙化合物(即碳原子填入铁晶体中的某些空隙),根据相关信息,你认为形成碳化铁的铁的三种晶体结构中,最有可能的是: 。(选填“α-Fe”、“γ-Fe”或“δ-Fe”)
已知CO2可以生产绿色燃料甲醇。CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH=-187.4 kJ/mol。3000C时的恒容密闭容器中,当C(CO2) = 1.00 mol.L-1 C(H2) =" 1.60" mol.L-1开始反应,结果如右图所示,回答下列问题:
CH3OH(g) + H2O(g) ΔH=-187.4 kJ/mol。3000C时的恒容密闭容器中,当C(CO2) = 1.00 mol.L-1 C(H2) =" 1.60" mol.L-1开始反应,结果如右图所示,回答下列问题:
(1)使用催化剂I时,反应在10小时内的平均反应速率:V(H2)= ______mol.(L.h)-1。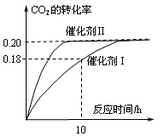
(2)下列叙述正确的是______。(双选)
A.当容器内气体的密度不再改变时,反应不一定达到平衡状态
B.充入氩气増大压强有利于提髙CO2的转化率
C.CO2平衡转化率:在上述反应条件下,催化剂II比催化剂I高
D.催化效率:在上述反应条件下,催化剂II比催化剂I高
(3)根椐图中数据,计算此反应在3000C时的平衡常数。(写出计箅过程)
(4)将上述平衡体系升温至400°C, 平衡常数:K(4000C) ______ K(3000C) (填<、=或> )。
(5)其它条件不变,若上述反应在催化剂Ⅱ,400°C下达到平衡,请在上图画出CO2转化率随时间变化图。
已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
Ⅰ.若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
a.甲+H2O 乙+丙??? b.乙
乙+丙??? b.乙 氧化物+H2O
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则甲发生a反应的化学方程式为:???????????????????????????
②若甲为某短周期金属元素的氯化物,则该金属在周期表中的位置是:??????????????? ;
若向30 mL 1 mol/L的甲的溶液中逐渐加入浓度为4 mol/L的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为????????? (选填编号).
A.3 mL??? B.7.5 mL? C.15 mL??? D.27.5 mL
③将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则负极发生的电极反应为??????????????????????? 。
Ⅱ.若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙 丙。则:
丙。则:
①写出上述反应的化学方程式????????????????????????????????? 。
②0.5 mol气体甲与足量的过氧化钠反应,转移电子的数目为??????????????????
③将一定量气体甲通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(甲)的关系如图所示,溶液A中各离子浓度由大到小的顺序为????????????????????????????????????? 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com