
题目列表(包括答案和解析)
A.向亚硫酸钠溶液中滴加过量的溴水
B.将物质的量浓度相等的KAl(SO4)2和Ba(OH)2溶液以体积比1∶2混合
C.等体积、等物质的量浓度的碳酸钠与氢氧化钡溶液混合
D.在NaBr溶液中通入过量氯气
①向硫酸铜溶液中加入适量铁粉
②等物质的量浓度、等体积的硫酸铵和氯化钡溶液
③等物质的量的碳酸氢钠与过氧化钠固体
④在溴化钠溶液中通入过量氯气
A.①② B.③④ C.①③ D.②④
混合物A由碳酸钠和碳酸氢钠组成.现有两包质量相等的混合物A:
(1)若向其中一包加入100 mL 3 mol/L的Ba(OH)2溶液(过量),使HCO3-、CO32-全部变为沉淀,过滤后,再向滤液中加入200 mL 2 mol/L的稀盐酸,溶液恰好呈中性.
①写出下列反应的离子方程式
碳酸氢钠与过量氢氧化钡的反应:________;
②混合物A中NaHCO3的质量为________g.
(2)若向另一包中先加50 mL 8 mol/L的HCl溶液,使HCO3-、CO32-全部变为CO2后,再加50 mL 2 mol/L的Ba(OH)2溶液,混合后的溶液pH=14(混合后溶液体积变化忽略不计、在常温下).混合物A中Na2CO3的质量为________g.
(1)甲同学的方案是:将样品溶解,加入过量氯化钡溶液,过滤,将沉淀洗涤、烘干,称量所得固体质量为n g。
①检验沉淀已经洗净的方法为____________________________________________。
②此混合物中碳酸钠质量分数的计算式为_________________________________________。
(2)乙同学的方案是:将样品溶解,加入过量氯化钡溶液,再滴入2—3滴酚酞试液,用a mol/L标准盐酸滴定,到达滴定终点时消耗盐酸b mL。
①乙同学在滴定过程中所需要的主要玻璃仪器有______________、______________。
②此混合物中碳酸钠质量分数的计算式为______________。
(3)丙同学的方案如下图所示:
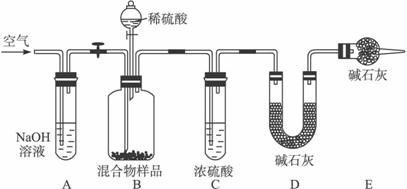
①装置C的作用是____________________________________________________。
②当混合物样品充分反应后,缓慢通入空气的目的是:_____________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com