
题目列表(包括答案和解析)
 A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半 径最小,A、D伺主族,可形成离子化合物DA;C、F同主族,可形成FC2,FC3两种分子B,D,E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元 素.请填写下列空白:
A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半 径最小,A、D伺主族,可形成离子化合物DA;C、F同主族,可形成FC2,FC3两种分子B,D,E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元 素.请填写下列空白:A、B、C、D、E、F六种短周期元素,原子序数依次增大,A、E同主族,D、F同主族,A元素的原子半径是所有原子中最小的,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E、F五种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)F元素在周期表中的位置 ,
(2)写出阴离子B22-的电子式(用B对应元素的元素符号来表示) 。
(3)常温下,X、Y的水溶液pH均为4,设X、Y水溶液中由水电离出的OH-浓度分别为
a、b,则a与b之比为 。
(4)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与
足量的Ba(OH)2溶液反应的离子方程式 。
(5)将铝片和镁片用导线连接,插入由A、D、E三种元素组成的化合物的稀溶液中构成
原电池,则负极的电极反应式为 。
(6)A单质与C单质在一定条件下可化合为乙,室温下,向pH=a的乙的水溶液中加入等
体积pH=b的X的水溶液,且a+b=14,充分作用后,该溶液中各种离子浓度由大到小的顺序为 。
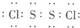
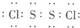
| a |
| 64 |
| a |
| 64 |
| 46Q |
| b |
| 46Q |
| b |
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。
请回答下列问题:
(1)E、F气态氢化物的稳定性为____________ > ______________(用化学式表示)。
(2)E与F可形成E2F2的化合物,其电子式为___________,其晶体类型为__________。
(3)C、D形成的一种化合物能与D、E形成的化合物在溶液中发生氧化还原反应,其离子方程式为: ______________________________________。
(4)A、C、E三种元素形成的一种常见化合物H,其浓溶液在加热条件下可与a g铜反应,则被还原的H的物质的量为___________________。
(5)E的一种常见氧化物为大气污染物,实验室可用足量D的最高价氧化物的水化物来吸收,则吸收生成的盐溶液中离子浓度大小关系为: ___________________________。
(6)b g D单质在纯净的C单质中燃烧放出Q kJ热量,则相关的热化学方程式为: __________。
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。
请回答下列问题:
(1)E、F气态氢化物的稳定性为____________ > ______________(用化学式表示)。
(2)E与F可形成E2F2的化合物,其电子式为_____________________,其晶体类型为________________。
(3)C、D形成的一种化合物能与D、E形成的化合物在溶液中发生氧化还原反应,其离子方程式为:
_______________________________________________________________________。
(4)A、C、E三种元素形成的一种常见化合物H,其浓溶液在加热条件下可与a g铜反应,则被还原的H的物质的量为___________________。
(5)E的一种常见氧化物为大气污染物,实验室可用足量D的最高价氧化物的水化物来吸收,则吸收生成的盐溶液中离子浓度大小关系为:
_____________________________________________________________________。
(6)b g D单质在纯净的C单质中燃烧放出Q kJ热量,则相关的热化学方程式为: _______________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com