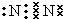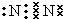向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
I.CH
4(g)+2O
2(g)═CO
2(g)+2H
2O(g)△H
1=-802.6kJ/mol
II.CH
4(g)+O
2(g)═CO
2(g)+2H
2(g)△H
2=-322.0kJ/mol
III.CH
4(g)+H
2O(g)═CO(g)+3H
2(g)△H
3=+206.2kJ/mol
Ⅳ.CH
4(g)+2H
2O(g)═CO
2(g)+4H
2(g)△H
4=+165.0kJ/mol
请回答下列问题:
(1)CH
4的燃烧热△H______△H
1.(填“>”、“<”或“=”).
(2)在反应初始阶段,反应II的反应速率大于反应III的反应速率.比较反应II的活化能E
II和反应III的活化能E
III的大小:E
II______E
III(填“>”、“<”或“=”).
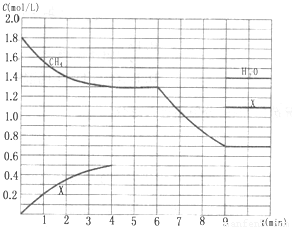
(3)在1L固定容积密闭容器中投入1.8mol CH
4和3.6mol H
2O(g),若只发生反应Ⅳ,测得CH
4、H
2O(g)及某一生成物的物质的量浓度(c)随反应时间(t)的变化如图所示[第9min前H
2O(g)的物质的量浓度及第4min~9min之间X所代表生成物的物质的量浓度变化曲线未标出,条件有变化时只考虑改变一个条件).
①0~4min内,H
2的平均反应速率υ(H
2)=______mol?
-1;
②反应在5min时的平衡常数K=______;
③第6min时改变的条件是______;判断理由是______;
④比较第5min时的平衡常数K
5min与第10min时平衡常数K
10min的大小:K
5min______K
10min (填“>”、“=”或“<”),原因是______.

 已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/[c(CH3OH)]2,该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44.
已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/[c(CH3OH)]2,该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44.

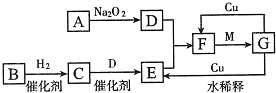 如图表示由短周期元素组成的一些物质之间的转化关系(某些反应产物已略去).各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体.
如图表示由短周期元素组成的一些物质之间的转化关系(某些反应产物已略去).各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体.