
题目列表(包括答案和解析)
已知:2H2(g) + O2(g) = 2H2O(g);△H= 483.6 kJ?![]() , H2(g) + 1/2O2(g) = H2O(l)的△H=285.8 kJ?
, H2(g) + 1/2O2(g) = H2O(l)的△H=285.8 kJ?![]() ,由此可知,在等温下蒸发45g液态水需吸收_____ kJ的热量。
,由此可知,在等温下蒸发45g液态水需吸收_____ kJ的热量。
4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);ΔH=-905 kJ·mol-1
4NO(g)+6H2O(g);ΔH=-905 kJ·mol-1
2H2(g)+O2(g)![]() 2H2O;ΔH=-483.6 kJ·mol-1
2H2O;ΔH=-483.6 kJ·mol-1
则N2(g)+3H2(g)![]() 2NH3(g)的ΔH=________。
2NH3(g)的ΔH=________。
(2)工业上在一定温度下,将一定量的N2和H2通入到体积为
①增大压强②增大反应物的浓度③使用催化剂④降低温度
(3)当化学反应N2(g)+2H2(g) ![]() 2NH3(g)达到平衡后改变某些条件(不改变N2、H2和NH3的用量),反应速率与反应时间的关系如下图,其中表示平衡混合物中NH3的含量最高的一段时间是___________________。当温度为T ℃时,将
2NH3(g)达到平衡后改变某些条件(不改变N2、H2和NH3的用量),反应速率与反应时间的关系如下图,其中表示平衡混合物中NH3的含量最高的一段时间是___________________。当温度为T ℃时,将

(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行下图所示实验:
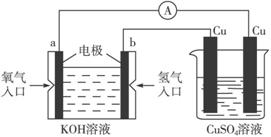
①请写出氢氧燃料电池中的电极反应式:
负极:____________________________________________________________;
正极:____________________________________________________________。
②上图装置中,某一铜电极的质量减轻了
[ ]
|
已知两个热化学方程式:C(s)+O2(g) 2H2(g)+O2(g) 现有炭粉和H2组成的悬浮气共0.2 mol,使其在O2中完全燃烧,共放出63.53 kJ的热量,则炭粉与H2的物质的量之比是 | |
| [ ] | |
A. |
1∶1 |
B. |
1∶2 |
C. |
2∶3 |
D. |
3∶2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com