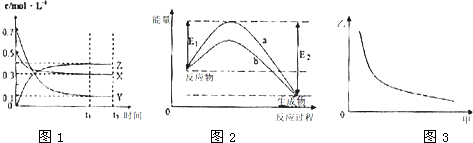
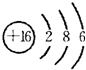
(2011?顺义区二模)X、Y、Z是中学化学常见的三种元素,其中,X、Z位于短周期.常温下,X单质为黄绿色气体;向含Y离子的溶液中滴加氢氧化钠溶液,生成白色絮状沉淀,迅速变为灰绿色,最后变为红褐色;Z的最外层电子数与核外电子总数之比为3:13.请回答下列问题:
(1)Z在元素周期表中的位置是
三周期ⅢA族
三周期ⅢA族
,X单质分子的电子式是
.
(2)Z单质与Y的氧化物在高温条件下反应是冶炼Y单质的一种方法,该反应化学方程式是
Fe
2O
3+2Al
Al
2O
3+3Fe或3Fe
3O
4+8Al
4Al
2O
3+9Fe或3FeO+2Al
Al
2O
3+3Fe
Fe
2O
3+2Al
Al
2O
3+3Fe或3Fe
3O
4+8Al
4Al
2O
3+9Fe或3FeO+2Al
Al
2O
3+3Fe
.
(3)含上述元素的某些物质常用于处理工业废水,部分流程如图1:
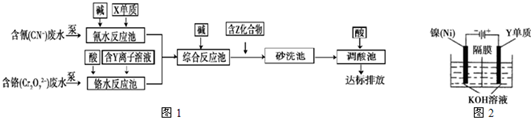
①处理含铬废水时,在反应池中Cr
2O
72-变为Cr
3+,当反应转移1mol 电子时,有
0.17
0.17
mol Cr
2O
72- 转化(计算结果保留两位小数).
②含Z化合物可以使水中悬浮颗粒发生凝聚,原因是
Al
3++3H
2O

Al(OH)
3+3H
+,铝离子水解产生氢氧化铝胶体,能吸附水中悬浮物,使之沉淀下来
Al
3++3H
2O

Al(OH)
3+3H
+,铝离子水解产生氢氧化铝胶体,能吸附水中悬浮物,使之沉淀下来
(用文字和化学用语表示).
③处理含氰废水时,CN
-最终转化为两种无毒的气体,该反应的离子方程式是
2CN-+5Cl2+8OH-=2CO2+N2+H2O+10Cl-
2CN-+5Cl2+8OH-=2CO2+N2+H2O+10Cl-
.
(4)利用图2方法电解可得到一种新型净水剂K
2YO
4,阳极的电极反应式为
Fe-6e-+8OH-=FeO42-+4H2O
Fe-6e-+8OH-=FeO42-+4H2O
.

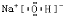

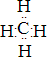
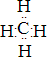
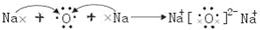
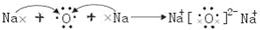
 2ZX3(g),在一定温度下的定容容器中,下列事实不能说明该反应已经达到平衡的标志的是
2ZX3(g),在一定温度下的定容容器中,下列事实不能说明该反应已经达到平衡的标志的是


 Al(OH)3+3H+,铝离子水解产生氢氧化铝胶体,能吸附水中悬浮物,使之沉淀下来
Al(OH)3+3H+,铝离子水解产生氢氧化铝胶体,能吸附水中悬浮物,使之沉淀下来 Al(OH)3+3H+,铝离子水解产生氢氧化铝胶体,能吸附水中悬浮物,使之沉淀下来
Al(OH)3+3H+,铝离子水解产生氢氧化铝胶体,能吸附水中悬浮物,使之沉淀下来