
题目列表(包括答案和解析)
下列有关物质的性质、应用等的说法中正确的是
| A.浓硫酸久置于空气中体积不会变化 |
| B.二氧化硫具有漂白性,与氯水混合使用效果更好 |
| C.合金的熔点可以低于它的成分金属 |
| D.Fe(OH)3胶体的本质特征是能产生丁达尔效应 |
下列有关物质的性质、应用等的说法中正确的是
A.浓硫酸久置于空气中体积不会变化
B.二氧化硫具有漂白性,与氯水混合使用效果更好
C.合金的熔点可以低于它的成分金属
D.Fe(OH)3胶体的本质特征是能产生丁达尔效应
| A.浓硫酸久置于空气中体积不会变化 |
| B.二氧化硫具有漂白性,与氯水混合使用效果更好 |
| C.合金的熔点可以低于它的成分金属 |
| D.Fe(OH)3胶体的本质特征是能产生丁达尔效应 |
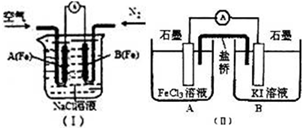 研究铁及铁的化合物的性质具有重要意义.
研究铁及铁的化合物的性质具有重要意义.硫酸具有以下A~F的性质:A.酸性 B.高沸点难挥发 C.吸水性 D.脱水性 E.强氧化性 F.溶于水放出大量热
(1)浓硫酸与铜共热发生反应的化学方程式为____________。实验中往往有大量白色固体析出,可见浓硫酸在该实验中表现了哪些性质:____________。(浓硫酸性质用A、B、C、D、E、F填空,下同)
(2)实验证明铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液。铜屑在此状态下被溶解的化学方程式为__________________________________。硫酸在该反应中表现了哪些性质:____________________________。
(3)在过氧化氢跟稀硫酸的混合溶液中加入铜片,常温下就生成蓝色溶液。写出有关反应的化学方程式:____________。与(2)中反应比较反应条件不同的原因是____________。
(4)蔗糖晶体中滴2~3滴水,再滴入适量的浓硫酸。发现加水处立即变黑,黑色区不断扩大,最后变成一块疏松的焦炭,并伴有刺激性气味气体产生。写出产生有刺激气味气体的化学方程式:____________________________。该实验中浓硫酸表现的性质有____________________。
(5)工业制备CuSO4溶液采用实验(2)的原理而没有采用实验(1)和(3)的原理,是因为(1)和(3)有某些缺点,请你列举(1)和(3)分别有哪此缺点:实验(1)____________________________;实验(3)____________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com