
题目列表(包括答案和解析)
用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
⑴将准确称取的4.23g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有 、 。
⑵取10.00mL待测液:用经过 (填写操作名称)的碱式滴定管量取至锥形瓶中,并加入2-3滴甲基橙。
⑶用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的 ,右手不停地向同一方向摇动锥形瓶,两眼注视 ,直到 为止,可判断滴定到达终点。
⑷根据下列数据,烧碱的纯度为 。
| 滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
(1)某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸。
①滴定管如图所示,用 滴定管盛装标准浓度的氢氧化钠溶液(填“甲”或“乙”)。

②用滴定的方法来测定盐酸的浓度,实验数据如下所示:
|
实验编号 |
待测HCl溶液的体积(mL) |
滴入NaOH溶液的体积(mL) |
|
1 |
20.00 |
23.00 |
|
2 |
20.00 |
23.10 |
|
3 |
20.00 |
22.90 |
该未知盐酸的浓度为(保留两位有效数字)_______________。
③下列操作会使所测得的盐酸的浓度偏低的是__________:
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数
(2)某课外活动小组为了测定某氯化锶(SrCl2)样品的纯度,设计了如下方案:称取1.0 g样品溶解于适量水中,向其中加入含AgNO3 2.38 g的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应生成沉淀的离子),Cl-即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.2 mol·L-1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度。
请回答下列问题:
①判断滴定达到终点的现象是_______________________________________________。
②考虑Ag+和Fe3+在酸或碱性溶液中的存在形式,在实施滴定的溶液以呈_____(选填“酸性”、“中性”或“碱性”)为宜。
③在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n(Cl-)的测定结果________(选填“偏高”、“偏低”或“无影响”)。
(1)某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸。
①滴定管如图所示,用 滴定管盛装标准浓度的氢氧化钠溶液(填“甲”或“乙”)。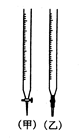
②用滴定的方法来测定盐酸的浓度,实验数据如下所示:
| 实验编号 | 待测HCl溶液的体积(mL) | 滴入NaOH溶液的体积(mL) |
| 1 | 20.00 | 23.00 |
| 2 | 20.00 | 23.10 |
| 3 | 20.00 | 22.90 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com