
题目列表(包括答案和解析)
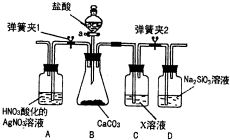 某同学为了验证碳和硅两种元素非金属性的相对强弱,用图所示装置进行实验(夹持仪器已略去,气密性已检验).
某同学为了验证碳和硅两种元素非金属性的相对强弱,用图所示装置进行实验(夹持仪器已略去,气密性已检验).| 假 设 | 实验方案 | 实验结论 | |
| 甲同学 | 酸性: H2CO3>C6H5OH |
取少量苯酚放入试管,加过量NaOH溶液得澄清溶液,冷却至室温,再通入一段时间CO2,冷却至室温,观察未出现浑浊 | 通入CO2未见浑浊说明CO2不能与C6H5ONa反应,假设错误 |
| 乙同学 | 酸性: C6H5OH>HCO3- |
方案(一):在苯酚的乳浊液中加一定量的Na2CO3固体,Na2CO3固体溶解,苯酚乳浊液变清,无气泡生成.放置冷却,再观察,混合物仍然澄清. 方案(二):在苯酚的乳浊液中加一定量的饱和Na2CO3溶液,乳浊液变清,无气泡生成. |
方案一结论:假设正确 方案二结论:假设正确 |
| 提出假设 | 实验方案和预测现象 |
| ① |
② |
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ?mol-1 | 347 | 305 | 259 |
 (3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如图一所示),其中3种离子晶体的晶格能数据如下表:
(3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如图一所示),其中3种离子晶体的晶格能数据如下表:| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
| 实验编号 | 实验操作 | 实验现象 |
| ① | 加入适量稀盐酸 | 有微量气泡,固体全部溶解,得到澄清溶液 |
| ② | 加入适量蒸馏水 | 固体部分溶解 |
| ③ | 加入适量无水乙醇 | 固体部分溶解 |


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com