A、【供选学《化学与生活》考生作答】
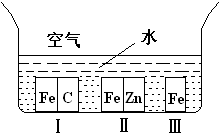
(1)如右图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是
(填序号)
(2)氟氯代烷是一种破坏臭氧层的物质.在大气平流层中,氟氯代烷受紫外线的照射分解出氯原子,氯原子参与下列有关反应:
①Cl+O
3→ClO+O
2;②O
3→O+O
2;③ClO→Cl+O
2上列反应的总反应式是
;
(3)碳酸氢钠是常见的疏松剂,主要是因为它在加热条件下产生了气体,使食品变得疏松.试写出碳酸氢钠受热分解的化学方程式
;
(4)垃圾资源化的方法是
.
A、填埋 B、焚烧 C、堆肥法 D、分类回收法
B【供选学《化学反应原理》考生作答】
设反应①Fe(s)+CO
2(g)═FeO(s)+CO(g)的平衡常数为K
1.反应②Fe(s)+H
2O(g)═FeO(s)+H
2(g)的平衡常数K
2,在不同温度下,K
1、K
2的值如下:
| 温度 |
K1 |
K2 |
| 973K |
1.47 |
2.38 |
| 1173K |
2.15 |
1.67 |
(1)从上表可以推断:反应①是
(填“吸”、“放”)热反应;反应②是
(填“吸”、“放”)热反应.
(2)现有反应③CO
2(g)+H
2(g)═CO(g)+H
2O(g)写出该反应的平衡常数K
3的数学表达式:K
3═
;
(3)书写热化学方程式:
①1mol N
2(g)与适量O
2(g)起反应,生成NO
2(g),吸收68KJ热量:
;
②NH
3(g)燃烧生成NO
2(g)和H
2O(g),已知
(1)2H
2(g)+O
2(g)═2H
2O(g)△H═-483.6kJ/mol
(2)N
2(g)+2O
2(g)═2NO
2(g)△H═+67.8kJ/mol
1,N
2(g)+3H
2(g)═2NH
3(g)△H═-92.0kJ/mol
NH
3(g)燃烧生成NO
2(g)和H
2O (g)热化学方程式:
.

 A、【供选学《化学与生活》考生作答】
A、【供选学《化学与生活》考生作答】