
题目列表(包括答案和解析)
⑴.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是 ▲ 。(可以多选)
A.用pH试纸测定Na2CO3溶液的pH
B.从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
C.实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
D.配制一定物质的量浓度的氯化钠溶液
E.取某溶液做焰色反应实验,说明该溶液中含有钠元素。
F.用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验。
G.促使过饱和的硝酸钾溶液析出晶体
H.用倾析法进行分离、洗涤颗粒较大的沉淀。
⑵.下列实验能达到实验目的且符合安全要求的是 ▲ 。(可以多选)
⑶. 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol·L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体中滴加一滴浓盐酸,再立即将表面皿盖好。已知:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol·L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体中滴加一滴浓盐酸,再立即将表面皿盖好。已知:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
①.e处发生反应的离子方程式为 ▲ ,该反应中发生反应的氧化剂和还原剂的物质的量
之比为 ▲ 。
②.b处的实验现象为 ▲ ,d处的实验现象为 ▲ 。
③.c处反应的化学方程式为 ▲ ,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,
转移电子的物质的量为 ▲ mol。
④.通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱? ▲ (填“能”或
“不能”),若能,其氧化性由强到弱的顺序是 ▲ 。
| 14(w2-w1) |
| a |
| 14(w2-w1) |
| a |
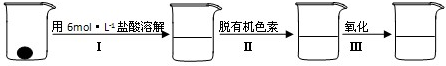
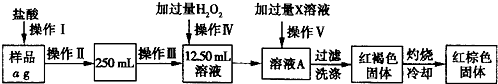
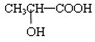 与铁粉作用生成的,请写出上述步骤②反应Ⅰ的化学方程式:
与铁粉作用生成的,请写出上述步骤②反应Ⅰ的化学方程式:(Ⅰ)(2分)下列操作会导致实验结果偏高的是
A.配制一定物质的量浓度的硫酸溶液时,定容摇匀后,发现液面低于刻度线。
B.配制一定物质的量浓度溶液时,定容时仰视读数,所得溶液的浓度
C.用天平称量20.5g某物质,砝码和药品的位置放反,所得药品的质量
D.10%的硫酸和90%的硫酸等体积混合配制50%的硫酸溶液
(Ⅱ)(2分)化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是
A.定性检验SO32-,可用HNO3酸化的BaCl2溶液
B. 配制FeCl2溶液时通常加少量HNO3酸化,减小其水解程度
C.检验某溶液中是否含Cl-,用HNO3酸化的AgNO3溶液
(Ⅲ)、离子反应是中学化学中重要的反应类型,回答下列问题:
(1)(2分)在发生离子反应的反应物或生成物中,一定存在有 (填编号)。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)(6分)一种无色透明溶液中,可能含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、HSO3-、HCO3-、I-和Cl-,取该溶液进行如下实验:
①将溶液滴在蓝色石蕊试纸上,呈红色。
②将少许溶液浓缩后加入铜片和硫酸,有无色气体析出,此气体通空气则立即变成红棕色。
③取少许溶液滴入BaCl2试液,则产生白色沉淀。
④取实验③中的澄清溶液,滴入AgNO3试液,产生不溶于稀HNO3的白色沉淀。
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解。
根据以上现象判断,原溶液中肯定不存在的离子是 ;肯定存在的离子是 ;不能作出判断的离子是 。
(Ⅰ)化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是________
A.定性检验SO32-,可用HNO3酸化的BaCl2溶液
B.配制FeCl2溶液时通常加少量HNO3酸化,减小其水解程度
C.检验某溶液中是否含Cl-,用HNO3酸化的AgNO3溶液
(Ⅱ)离子反应是中学化学中重要的反应类型,回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有________(填编号).
①单质
②氧化物
③电解质
④盐
⑤化合物
(2)一种无色透明溶液中
,可能含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、HSO3-、HCO3-、I-和Cl-,取该溶液进行如下实验:①将溶液滴在蓝色石蕊试纸上,呈红色.
②将少许溶液浓缩后加入铜片和硫酸,有无色气体析出,此气体通空气则立即变成红棕色.
③取少许溶液滴入BaCl2试液,则产生白色沉淀.
④取实验③中的澄清溶液,滴入AgNO3试液,产生不溶于稀HNO3的白色沉淀.
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解.
根据以上现象判断,原溶液中肯定不存在的离子是________;肯定存在的离子是________;不能作出判断的离子是________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com