
题目列表(包括答案和解析)
甲同学向0.5 mol/L的 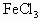 溶液中滴加0.1 mol/L的KI溶液即呈现红棕色,再加入
溶液中滴加0.1 mol/L的KI溶液即呈现红棕色,再加入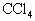 振荡后静置,可观察到
振荡后静置,可观察到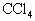 层呈紫红色;乙同学在0.5 mol/L的
层呈紫红色;乙同学在0.5 mol/L的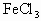 溶液中先加入4 mol/L的
溶液中先加入4 mol/L的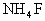 溶液,发现
溶液,发现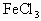 溶液褪至无色,而后再加0.1mol/L的KI溶液,不呈现红棕色,再加
溶液褪至无色,而后再加0.1mol/L的KI溶液,不呈现红棕色,再加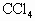 振荡,静置,也观察不到
振荡,静置,也观察不到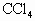 层有紫红色出现.
层有紫红色出现.
(1)甲同学的实验说明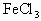 溶液和KI溶液发生了什么反应(用离子方程式表示):________.
溶液和KI溶液发生了什么反应(用离子方程式表示):________.
(2)乙同学观察不到甲同学的实验现象,其原因分析合理的是
[ ]
A.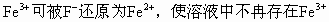
B. 反应
反应
C.![]()
(3)乙同学所用的 溶液是用塑料瓶盛装的,可否改用玻璃试剂瓶?________.
溶液是用塑料瓶盛装的,可否改用玻璃试剂瓶?________.
(4)在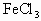 溶液中,加入适量的
溶液中,加入适量的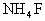 溶液后,溶液中
溶液后,溶液中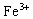 浓度几乎降为零,用什么简便实验可以检验这种说法的正确性?________.
浓度几乎降为零,用什么简便实验可以检验这种说法的正确性?________.
有关阿伏伽德罗常数的说法正确的是( )
①62 g白磷中含有2 NA个白磷分子
②标准状况下,5.05g一氯甲烷所占的密度约为2.25g/L
③浓度分别为1 mol/L和0.5 mol/L的NH3.H2O和NH4Cl的混合溶液共1 L,则
n(NH3) + n(NH3.H2O)+n(NH4+) == 1.5 mol
④1 mol冰醋酸中含有NA个CH3COO-
⑤1 L0.2 mol/LAl(NO3)3溶液中含有0.2NA个Al3+
⑥在石英晶体中,NA个硅原子形成4NA个共价键
A、①②③④⑤⑥ B、②③⑥ C、③④⑤⑥ D、④⑤⑥
 、Cl-、I-
、Cl-、I- 、Cl-
、Cl- 、Cl-
、Cl-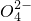
|
下列叙述不正确的是 | |
| [ ] | |
A. |
25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
B. |
一定温度下,1 L 1 mol/L的氨水与2 L 0.5 mol/L的氨水中,n(NH4+)前者多 |
C. |
相同体积、相同物质的量浓度的盐酸、醋酸,稀释相同倍数后,溶液的pH:盐酸<醋酸 |
D. |
0.2 mol/L的一元酸HX与0.1 mol/L的KOH溶液等体积混合所得溶液中,一定有:a(H+)+c(K+)=c(OH-)+c(X-) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com