研究CO
2的利用对促进低碳社会的构建具有重要的意义.
(1)将CO
2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe
2O
3(s)+3C(石墨)=2Fe(s)+3CO(g)△H
1=+489.0kJ?mol
-1C(石墨)+CO
2(g)=2CO(g)△H
2=+172.5kJ?mol
-1则CO还原Fe
2O
3(s)的热化学方程式为
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5KJ/mol
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5KJ/mol
.
②已知Fe与CO可形成五羰基铁[Fe(CO)
5],该化合物相当活泼,易于吸收H
2生成氢化羰基铁.氢化羰基铁为二元弱酸,可与NaOH反应生成四羰基铁酸二钠.
试写出五羰基铁吸收H
2的反应方程式
Fe(CO)5+H2=H2Fe(CO)4+CO
Fe(CO)5+H2=H2Fe(CO)4+CO
.
③利用燃烧反应可设计成CO-O
2燃料电池(以KOH溶液为电解液),写出该电池的负极反应式
CO+4OH--2e-=CO32-+2H2O
CO+4OH--2e-=CO32-+2H2O
.
(2)某实验将CO
2和H
2充入一定体积的密闭容器中,在两种不同条件下发生反应:
CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)△H=-49.0kJ?mol
-1测得CH
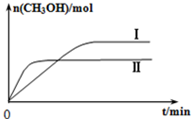
3OH的物质的量随时间变化如图所示,回答问题:
①该反应的平衡常数表达式为
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
.
②曲线I、Ⅱ对应的平衡常数大小关系为K
Ⅰ大于
大于
K
Ⅱ(填“大于”、“等于”或“小于”).
③一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容 器 |
甲 |
乙 |
| 反应物投入量 |
1molCO2、3molH2 |
a molCO2、b molH2、
c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为
0.4<c≤1
0.4<c≤1
.


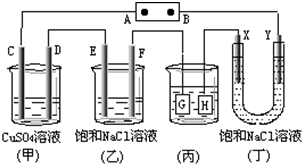 如图所示的装置,C、D、E、F、Y都是惰性电极,X是铁电极.将电源接通一段时间后,向(乙)中滴入酚酞溶液,在F极附近显红色.以下说法不正确的是( )
如图所示的装置,C、D、E、F、Y都是惰性电极,X是铁电极.将电源接通一段时间后,向(乙)中滴入酚酞溶液,在F极附近显红色.以下说法不正确的是( ) 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.