
题目列表(包括答案和解析)
| A.V1>V2>V3 | B.V1<V2=V3 |
| C.V1<V2<V3 | D.V1=V2<V3 |
中和相同体积、相同pH值的Ba(OH)2、NaOH和NH3·H2O三种稀溶液,所用相同物质的量浓度的盐酸的体积分别为V1、V2、V3,则三者关系为
| A.V1>V2>V3 | B.V1<V2=V3 |
| C.V1<V2<V3 | D.V1=V2<V3 |
下列
物质①Cu
②液态SO2
③纯醋酸
④NaHCO3
⑤Ba(OH)2溶液
Ⅰ、属于非电解质的是________;(填序号)
Ⅱ、(1)NaHCO3是一种________(填“强”或“弱”)电解质;
(2)写出HCO3―水解的离子方程式:________;
(3)常温下,0.1 mol·L-1 NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、H2CO3、CO32―、OH-五种微粒的浓度由大到小的顺序为:________.
(4)常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1.若忽略水的电离及H2CO3的第二级电离,则H2CO3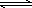 HCO3-+H+的平衡常数K1=________.(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=________.(已知:10-5.60=2.5×10-6)
Ⅲ、Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液.
(1)该Ba(OH)2溶液的物质的量浓度为________;
(2)溶液中由水电离出c(OH―)=________;
(3)与某浓度盐酸溶液按体积比(碱与酸之比)1∶9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=________.
Ⅳ、醋酸是一种弱电解质.
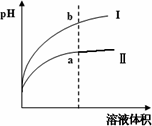
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如下图所示.则图________(填“Ⅰ”或“Ⅱ”)为醋酸稀释的图像.
Ⅰ、用”>“、“=’’或“<"符号表示以下各问中量的关系.
(1)pH
相同的氨水、氢氧化钠和氢氧化钡溶液,分别用蒸馏水稀释到原来的X倍、Y倍、Z倍,稀释后三种溶液的pH仍相同,则X、Y、Z之间大小的关系是________.(2)
相同体积、相同物质的量浓度的氨水、氢氧化钠和氢氧化钡三种稀溶液与盐酸完全反应,消耗同浓度的盐酸的体积分别为V1、V2、V3,则三者关系为________.(3)相同温度、相同物质的量浓度的七种溶液:
①H2SO4,
②NaCl,
③NaHSO4,
④CH3COOH,
⑤NH3H2O,
⑤NaOH,
⑦Ba(OH)2.
按
pH由大到小的顺序排列,正确顺序是(填写编号)________Ⅱ、
在一容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的反应.
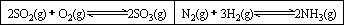
(1)
若起始时左侧投入2 mol SO2、1 mol O2,右侧投入1 mol N2、4 mol H2,达到平衡后,隔板是否可能处于中央位置?________(填“可能”或“不可能”).(2)
若起始时左侧投入2 mol SO2、1 mol O2,右侧投入1 mol N2、2 mol H2,达到平衡后,隔板处于中央位置,则SO2的转化率与N2的转化率之比为________.(3)
若起始时左侧投入2 mol SO2、1 mol O2,右侧投入1 mol N2、a mol H2且起始时右侧体积小于左侧体积,调节反应器至某一温度(两侧温度相同),使平衡时隔板处于中央位置,此时SO2的转化率与N2的转化率之比为5∶1,则a的取值范围为________.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com