
题目列表(包括答案和解析)
用废铁屑与稀硫酸反应,可制得硫酸亚铁。在100C和500C时,FeSO4在 100 g水中的溶解度分别为20.5 g和 48.6g.常温下,从溶液中析出的晶体是FeSO4?7H2O。现取 200 ml 0.500 mol/L H2SO4溶液,将 8.00 g废铁屑加入到上述稀H2SO4中,并不断搅拌,反应约 15 min后过滤。滤液在80℃经蒸发、浓缩,冷却至10℃后析出FeSO4?7H2O晶体。
(1)若加入的废铁不是粉状而是块状,对反应的影响是 。
A.会降低反应速率 B.会减少绿矾产量
C.需要加热才反应 D.将增大反应体系的PH值
(2)反应 15 min后过滤,其目的是 。
(3)滤液中除 FeSO4和可能未反应完全的H2SO4外,最可能存在的无机杂质是 。它是由 而产生的,其检测的方法是 。
(4)设 H2SO4与铁完全反应,当将滤液蒸发浓缩后,冷却至 500C时,溶液的体积约为50.0 ml,该溶液是否达饱和?试通过计算加以说明。(500C时,FeSO4饱和溶液的密度为1.36 g/cm3)
(5)若要计算在800C下将溶液蒸发至体积为70.0 ml,再冷却至100C时,所得到的FeSO4 ?7H2O的质量,你认为 (填编号),并简述所选之理由。答 。
A.前面提供的数据已经足够
B.还需要提供 100C时饱和溶液的密度: 1.42 g/cm3
C.还需要提供 800C时溶液的密度:1.30 g/cm3
D.还需要提供结晶后剩余溶液的体积:52.0 ml
(6)根据第(5)小题你的选择项(如选A则直接计算,如选B、C或D则可选用其数据)计算从100C 50.0 ml溶液中结晶析出的FeSO4?7H2O的质量。(本大题计算结果保留3位有效数字)
(1)写出下列物质的电离方程式.
H2CO3:________,NH4HSO4:________.
(2)有相同体积物质的量浓度都是1.0 mol·L-1的硫酸、盐酸和醋酸三种溶液,设它们的pH值分别为a,b,c.按由大到小的顺序排列:________.
(3)将质量相同的铁粉分别放入pH值相同的三杯溶液中,它们分别为硫酸,醋酸,盐酸.刚开始时三者的速率分别记为v1,v2,v3,则三者大小关系为:________.若三种酸溶液的量都足量,铁粉在三种溶液中溶解所消耗的时间分别记为t1,t2,t3.则三者之间的大小关系为:________.
(4)电离常数K表示电解质电离的能力,K愈小,表示电离程度愈________(填大或小).K随温度升高而________(填增大或减小),原因是:________.
(16分)最近全国各地持续出现雾霾天气,其首要污染物是可吸入颗粒物PM2.5和氮、硫的氧化物(PM2.5直径接近2.5×10-6m,1纳米=10-9m),主要来源为工业废气、机动车尾气等。因此对PM2.5、SO2、NOx进行研究、处理意义重大。
(1) 下列关于PM2.5说法正确的是
a.PM2.5在空气中形成了胶体;
b.PM2.5表面积大,能吸附大量有毒、有害物质;
c.少开私家车,尽量选择公交、地铁出行,某种程度可以减少PM2.5污染
(2) 取PM2.5样本用蒸馏水处理制得试样,若测得该试样所含水溶性无机离子及其平均
浓度如下表
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/ mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
 2NO(g) △H=+180.5kJ·mol-1
2NO(g) △H=+180.5kJ·mol-1  2CO(g) △H ="-" 221.0 kJ·mol-1
2CO(g) △H ="-" 221.0 kJ·mol-1 CO2( g) △H ="-" 393.5 kJ·mol-1
CO2( g) △H ="-" 393.5 kJ·mol-1
(16分)最近全国各地持续出现雾霾天气,其首要污染物是可吸入颗粒物PM2.5和氮、硫的氧化物(PM2.5直径接近2.5×10-6m,1纳米=10-9m),主要来源为工业废气、机动车尾气等。因此对PM2.5 、SO2、NOx进行研究、处理意义重大。
(1) 下列关于PM2.5说法正确的是
a.PM2.5在空气中形成了胶体;
b.PM2.5表面积大,能吸附大量有毒、有害物质;
c.少开私家车,尽量选择公交、地铁出行,某种程度可以减少PM2.5污染
(2) 取PM2.5样本用蒸馏水处理制得试样,若测得该试样所含水溶性无机离子及其平均
浓度如下表
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/ mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中的数据判断该试样的酸碱性为 ,其pH= 。
(3)对汽车尾气中的NOx进行研究
①NOx能形成酸雨,写出NO2转化为HNO3的化学方程式 。
②汽车尾气系统中装有催化转化器,可将NOx还原成N2排出,已知下列热化学方程式:
ⅰ N2(g) +O2(g)  2NO(g) △H=+180.5kJ·mol-1
2NO(g) △H=+180.5kJ·mol-1
ⅱ 2C(s)+ O2(g) 2CO(g) △H =- 221.0 kJ·mol-1
2CO(g) △H =- 221.0 kJ·mol-1
ⅲ C(s)+ O2(g) CO2( g) △H =- 393.5 kJ·mol-1
CO2( g) △H =- 393.5 kJ·mol-1
温度升高,反应ⅲ化学平衡常数 。(填“增大”或“减小”或“不变”)
写出NO(g)和CO(g) 反应生成N2(g) CO2(g)的热化学方程式 。
(4)将工厂废气中产生的SO2通过下列流程,可以转化为有应用价值的硫酸钙等
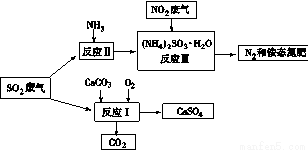
①写出反应Ⅰ的化学方程式: 。
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是 。
③检验经过反应Ⅲ得到的氨态氮肥中SO42-所用试剂是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com