实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
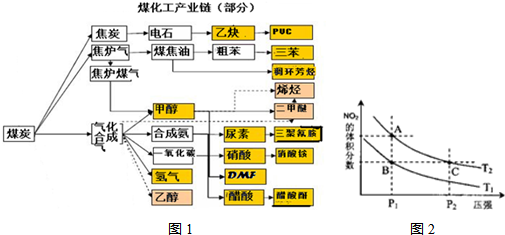
(1)该产业链中属于高中阶段常见的在低温下能自发进行的反应是:
N2+3H2?2NH3或NH3+HNO3═NH4NO3
N2+3H2?2NH3或NH3+HNO3═NH4NO3
(2)已知该产业链中某反应的平衡表达式为:
K=
它所对应的化学反应为:
C(s)+H2O(g)?CO(g)+H2(g)
C(s)+H2O(g)?CO(g)+H2(g)
(3)已知在一定温度下,
C(s)+CO
2(g)?2CO(g)平衡常数K
1;
CO(g)+H
2O(g )?H
2(g)+CO
2(g)平衡常数K
2;
C(s)+H
2O(g)?CO(g)+H
2(g) 平衡常数K
3;
则K
1、K
2、K
3之间的关系是:
K3=K1×K2
K3=K1×K2
.
(4)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H
2O(g)?H
2(g)+CO
2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
该反应的正反应方向是
放热
放热
反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为:
75%
75%
.
(5)从图1看出氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO
2、N
2O
4等.已知NO
2和N
2O
4的结构式分别是

和

.实验测得N-N键键能为167kJ?mol
-1,NO
2中氮氧键的键能为466kJ?mol
-1,N
2O
4中氮氧键的键能为438.5kJ?mol
-1.请写出NO
2转化为N
2O
4的热化学方程式
2NO2(g)?N2O4(g)△H=-57kJ?mol-1
2NO2(g)?N2O4(g)△H=-57kJ?mol-1
.对反应N
2O
4(g)?2NO
2(g),在温度为T
1、T
2时,平衡体系中NO
2的体积分数随压强变化曲线如图2所示.下列说法正确的是
D
D
.
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(6)0.2mol/L的NaOH与0.4mol/L的上述产业链中一产品化肥硝酸铵溶液等体积混合后,溶液中所有分子和离子( 除水和氨分子外)等微粒从大到小的顺序是
c(NO3-)>c(NH4+)>c(Na+)>c(NH3?H2O)>c(OH-)>c(H+)
c(NO3-)>c(NH4+)>c(Na+)>c(NH3?H2O)>c(OH-)>c(H+)
.
(7)以上述产业链中甲醇为燃料制成燃料电池,请写出在氢氧化钾介质中该电池的负极反应式
CH3OH+8OH--6e-═CO32-+6H2O
CH3OH+8OH--6e-═CO32-+6H2O
.

 2SO3(g) ΔH=-92.3KJ/mol
2SO3(g) ΔH=-92.3KJ/mol 


 2SO3(g) ΔH=-92.3KJ/mol
2SO3(g) ΔH=-92.3KJ/mol 


 (2010?揭阳模拟)草酸(H2C2O4)是一种有机二元酸,水溶液中草酸的存在形态有三种,各形态的浓度分数α(H2C2O4-α0,HC2O4--α1,C2O42--α2)随溶液pH变化的关系如图所示.
(2010?揭阳模拟)草酸(H2C2O4)是一种有机二元酸,水溶液中草酸的存在形态有三种,各形态的浓度分数α(H2C2O4-α0,HC2O4--α1,C2O42--α2)随溶液pH变化的关系如图所示.
 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式