
题目列表(包括答案和解析)
亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌。以下是用过氧化氢法生产亚氯酸钠的工艺流程图: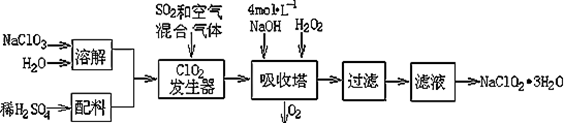
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O ;
②Ksp(FeS)=6.3×10-18 ; Ksp(CuS)=6.3×10-36 ;Ksp(PbS)=2.4×10-28
(1)吸收塔内发生反应的离子方程式为 。该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2。若用二氧化氯和浓盐酸制取Cl2,当生成5 mol Cl2时,通过还原反应制得氯气的质量为 g。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是 (填写序号)。
a蒸馏;b灼烧;c过滤;d冷却结晶;e蒸发
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。
下表是 25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 | HClO2 | HF | HCN | H2S |
| Ka/mol?L-1 | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10?8 K2=1.1×10?12 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com