电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
| 化学式 |
HF |
H2CO3 |
HClO |
电离平衡常数
(Ka) |
7.2×10-4 |
K1=4.4×10-7
K2=4.7×10-11 |
3.0×10-8 |
(1)已知25℃时,①HF(aq)+OH
-(aq)=F
-(aq)+H
2O(l)△H=-67.7kJ/mol,②H
+(aq)+OH
-(aq)=H
2O(l)△H=-57.3kJ/mol,氢氟酸的电离方程式及热效应可表示为
.
(2)将浓度为0.1mol/LHF溶液加水稀释一倍(假设温度不变),下列各量增大的是
.
A.c(H+) B.c(H
+)?c(OH
-) C.
D.
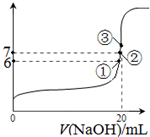
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是
.
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H
+)相等
B.①点时pH=6,此时溶液中,c(F
-)-c(Na
+)=9.9×10
-7mol/L
C.②点时,溶液中的c(F
-)=c(Na
+)
D.③点时V=20mL,此时溶液中c(F
-)<c(Na
+)=0.1mol/L
(4)物质的量浓度均为0.1mol/L的下列四种溶液:①Na
2CO
3溶液②NaHCO
3溶液③NaF溶液④NaClO溶液.
依据数据判断pH由大到小的顺序是
.
(5)Na
2CO
3溶液显碱性是因为CO
32-水解的缘故,请设计简单的实验事实证明之
.
(6)长期以来,一直认为氟的含氧酸不存在.1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F.HFO与水反应得到HF和化合物A,每生成1molHF转移
mol电子.

 25℃时,在20mL0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1醋酸溶液,pH的变化曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )
25℃时,在20mL0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1醋酸溶液,pH的变化曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )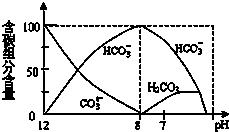 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.
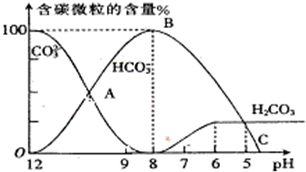 I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题:
I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题: H++HA- HA-
H++HA- HA- H++A2-
H++A2-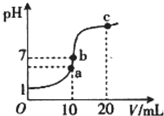 25℃时,在20mL0.1mol.L-1盐酸中逐滴加入0.2mol.L-1的氨水,溶液的pH与所加氨水的体积关系如图所示,下列有关粒子浓度的关系不正确的是( )
25℃时,在20mL0.1mol.L-1盐酸中逐滴加入0.2mol.L-1的氨水,溶液的pH与所加氨水的体积关系如图所示,下列有关粒子浓度的关系不正确的是( )