
题目列表(包括答案和解析)
| 点燃 |
| 溶于水惰性电极电解 |

(1)若甲是中学化学中常见的红棕色粉末状固体,则单质A与NaOH溶液反应的离子方程式为________________;A与甲反应在工业上一个重要用途是________________。
(2)若乙的水溶液呈弱酸性,丙是一种大气污染物,有刺激性气味。试写出乙在水溶液中发生电离时的电离方程式:________________;丙与乙反应的化学方程式:________________。
(3)若乙的水溶液呈弱碱性,并可用作农业化肥,D通常状况下为气体,则进行下列研究:现将0.40 mol C和0.20 mol D充入

①若t1=10 min,则0至t1时间内C物质的平均反应速率为________________;该反应在t2时达到平衡,其化学反应方程式为________________。
②根据图中曲线变化情况判断,t1时刻改变的反应条件可能是________________。
a.加入了催化剂
b.降低了反应的温度
c.向容器中又充入了气体D
已知A、B为单质,C为化合物,他们之间存在如下转化关系:

则下列说法中正确的是( )
①若C溶于水后得到强碱溶液,则A可能是Na
②若向C溶液中逐滴加入NaOH溶液的过程中溶液中出现白色沉淀并逐渐溶解至消失,则A可能是Al
③若C的溶液遇NaHCO3固体放出CO2气体,则A可能是H2
④若C的溶液中滴加KSCN溶液显红色,则B可能为Fe
⑤若C的溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①②③ B.②④ C.③⑤ D.①④⑤
| 点燃 |
| 溶于水惰性电极电解 |
| A.①②③ | B.②④ | C.③⑤ | D.①④⑤ |
已知A、B为常见的金属单质,C、D为常见的非金属单质,甲、乙、丙为三种常见的化合物,它们之间的相互转化关系如下图所示(部分产物及反应条件没有列出):
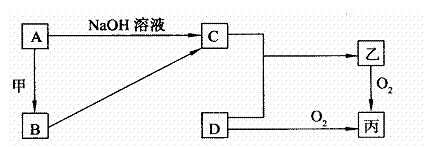
(1)若甲是中学化学中常见的红棕色粉末状固体,则单质A与NaOH溶液反应的离子方程式为 ;B在潮湿的空气中易发生电化学腐蚀,写出其发生电化学腐蚀时原电池负极的电极反应式: 。
(2)若乙在水溶液呈弱酸性,丙是一种大气污染物,有刺激性气味。试写出乙在水溶液中发生电离时的电离方程式 ;已知16g固体单质D完全燃烧转化成乙时,放出148.4kJ的热量,则该反应的热化学方程式为 。
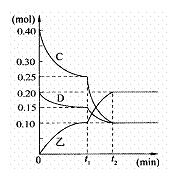
(3)若乙在水溶液呈弱碱性,并可用作农业化肥,D常况下为气体,则进行下列研究: 现将0.40 mol C和0.20 mol D充入10L的密闭容器中,在一定条件下使其发生反应,有关C、D、乙三者的物质的量的变化与时间的关系如右图所示:
①若t1 = 10min,则0至t1时间内C物质的平均反应速率为 ;该反应在t2时达到平衡,其化学反应方程式为 ,此温度下的该反应的平衡常数为 。
②根据图中曲线变化情况判断,t1时刻改变的反应条件可能是 (填下列各项序号)
a.加入了催化剂
b.降低了反应的温度
c.向容器中又充入了气体D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com