
题目列表(包括答案和解析)
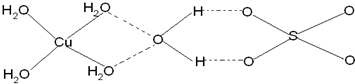
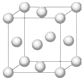 铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+1、+2 等,故能形成多种铜的化合物.
铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+1、+2 等,故能形成多种铜的化合物.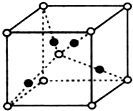 【化学一选修3物质结构与性质】
【化学一选修3物质结构与性质】| 电离能 | I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| (KJ.mol-1) | 14.5 | 29.6 | 47.4 | 77.5 | 97.9 | 551.9 | 666.8 |
| X | Y | Z | |
| I1 | 496 | 738 | 577 |
| I2 | 4562 | 1451 | 1817 |
| I3 | 6912 | 7733 | 2754 |
| I4 | 9540 | 10540 | 11578 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com